题目内容
20.下列说法正确的是( )| A. | 铁是一种非常活泼的金属 | B. | 镁可以与氧气反应生成氧化镁 | ||
| C. | 钠的硬度大 | D. | 铝的常见氧化物是Al3O4 |
分析 A.根据铁的化学性质进行分析;
B.依据镁与氧气反应生成氧化镁解答;
C.依据钠的物理性质解答;
D.铝的常见的化合价为+3价;
解答 解:A.铁的化学性质比较活泼,故A错误;
B.镁可以与氧气反应生成氧化镁,故B正确;
C.钠是一种质软的金属,硬度小,故C错误;
D.铝的常见氧化物是Al2O3,故D错误;
故选:B.
点评 本题考查了元素化合物知识,熟悉常见金属的物理性质、化学性质即可解答,题目难度不大.

练习册系列答案
相关题目
10.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为( )
| A. | N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H=38.6kJ•mol-1 | |
| D. | 不能确定 |
15.目前用14C呼气试验来检查幽门螺杆菌,从而达到检测和预防胃溃疡、慢性胃炎、胃癌的目的,下列说法正确的是( )
| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
12.下列离子方程式书写正确的是( )
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
16.离子是构成物质的基本微粒之一,下表中是中学常见的离子:
回答下列问题:
(1)Cl-离子的结构示意图是 . Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
. Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
(2)将含OH-离子的溶液 滴入浓度均为0.1 mol/L的Al3+和NH4+的混合溶液中,若测得溶液中NH4+减少了一半,此时,溶液中不存在(填“存在”或“不存在”)大量的Al3+.
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,A的溶液显酸性,将A、B两溶液混合,微热,既有白色沉淀,又有使湿润的红色石蕊试纸变蓝的气体生成.
则B的阳离子是Ba2+,用离子方程式表示A溶液显酸性的原因NH4++H2O NH3•H2O+H+.
NH3•H2O+H+.
(4)常温下,将(NH4)2CO3溶于水,得到含有大量NH4+和CO32-的溶液,往溶液中滴入少量氨水,测得溶液中N H4+和CO32 -的浓度比为2:1,此时该溶液的pH<( 填“<”、“=”或“>”)7.
(5)在微生物作用的条件下,NH4+可被空气氧化成NO3-.写出该反应的离子方程式:NH4++2O2=NO3-+H2O+2H+.
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则ν(H2)=0.048mol.L-1.min-1,此时N2的转化率为40%;若继续通入0.10mol N2和0.30molH2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”).
| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、CO32- |
(1)Cl-离子的结构示意图是
 . Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
. Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.(2)将含OH-离子的溶液 滴入浓度均为0.1 mol/L的Al3+和NH4+的混合溶液中,若测得溶液中NH4+减少了一半,此时,溶液中不存在(填“存在”或“不存在”)大量的Al3+.
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,A的溶液显酸性,将A、B两溶液混合,微热,既有白色沉淀,又有使湿润的红色石蕊试纸变蓝的气体生成.
则B的阳离子是Ba2+,用离子方程式表示A溶液显酸性的原因NH4++H2O
 NH3•H2O+H+.
NH3•H2O+H+.(4)常温下,将(NH4)2CO3溶于水,得到含有大量NH4+和CO32-的溶液,往溶液中滴入少量氨水,测得溶液中N H4+和CO32 -的浓度比为2:1,此时该溶液的pH<( 填“<”、“=”或“>”)7.
(5)在微生物作用的条件下,NH4+可被空气氧化成NO3-.写出该反应的离子方程式:NH4++2O2=NO3-+H2O+2H+.
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则ν(H2)=0.048mol.L-1.min-1,此时N2的转化率为40%;若继续通入0.10mol N2和0.30molH2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”).
17.氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,破坏2mol氯气中的化学键消耗的能量为Q1kJ,破坏2mol氢气中的化学键消耗的能量为Q2kJ,形成4mol氯化氢的化学键释放的能量为Q3kJ.下列关系式中正确的是( )
| A. | Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
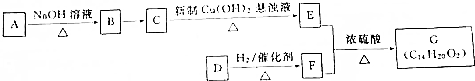
 或
或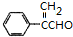 .
.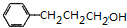 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$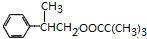 +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+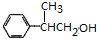 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$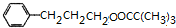 +H2O.
+H2O. .
.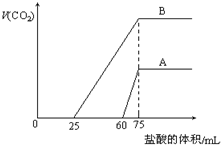 取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题: