题目内容
2.下列说法正确的是( )| A. | 气体的摩尔体积约为22.4L•mol-1 | |
| B. | 在标准状况下,1mol任何物质所占的体积都约为22.4L | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等,都是98g/mol |
分析 A.温度、压强影响气体摩尔体积;
B.在标准状况下,1mol任何气体物质所占的体积都约为22.4L,物质并不都是气体;
C.HNO3的摩尔质量是63g/mol;
D.摩尔质量以g/mol为单位,数值上等于其相对分子质量.
解答 解:A.标况下气体的摩尔体积约为22.4L•mol-1,由于温度、压强影响气体摩尔体积,故不同状态下下气体的摩尔体积不一定为22.4L•mol-1,故A错误;
B.在标准状况下,1mol任何气体物质所占的体积都约为22.4L,物质并不都是气体,故B错误;
C.1mol HNO3的质量是63g,HNO3的摩尔质量是63g/mol,故C错误;
D.硫酸和磷酸的相对分子质量均为98,二者摩尔质量都是98g/mol,故D正确,
故选:D.
点评 本题考查气体摩尔体积、摩尔质量,比较基础,注意根据PV=NRT理解温度、压强对气体摩尔体积的影响.

练习册系列答案
相关题目
12.四氯化钛(T1Cl4)是制取航天航空工业材料--钛合金的重要原料.实验室以TiO2和CCl4为原料制取液态TiCl4的装置如图所示(部分夹持装詈省略).

已知:
①制取TiC14的反应原理为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g)
②有关物质的性质如下表:
请回答下列问题:
(1)仪器N的名称是圆底烧瓶,仪器A中盛装的试剂是碱石灰.
(2)检查装置气密性的方法是关闭止水夹K,在装置E中加入水浸没长导管下端,在水槽M中加入热水,装置E的长
导管口有气泡产生,移去水槽M,一段时间后,导管中形成一段水柱,则说明装置气密性
良好(或其他合理答案)
反应前通入N2的目的是排除装置中的空气,保证反应在无氧无水环境下进行
(3)装置B中热水的作用是使CCl4汽化.
(4)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(5)TiC14还可由TiO2、焦炭和氯气在加热条件下反应制得,同时有气体生成,请设计实验方案探究气体中是否同时含有CO和CO2两种气体:将气体先通过澄清石灰水,干燥后再通人装有灼热Cu0的玻璃管中,若澄清石灰水变浑
浊且玻璃管中有红色固体生成,则气体中同时含有CO与C02两种气体(或其他合理答
案).

已知:
①制取TiC14的反应原理为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g)
②有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)仪器N的名称是圆底烧瓶,仪器A中盛装的试剂是碱石灰.
(2)检查装置气密性的方法是关闭止水夹K,在装置E中加入水浸没长导管下端,在水槽M中加入热水,装置E的长
导管口有气泡产生,移去水槽M,一段时间后,导管中形成一段水柱,则说明装置气密性
良好(或其他合理答案)
反应前通入N2的目的是排除装置中的空气,保证反应在无氧无水环境下进行
(3)装置B中热水的作用是使CCl4汽化.
(4)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(5)TiC14还可由TiO2、焦炭和氯气在加热条件下反应制得,同时有气体生成,请设计实验方案探究气体中是否同时含有CO和CO2两种气体:将气体先通过澄清石灰水,干燥后再通人装有灼热Cu0的玻璃管中,若澄清石灰水变浑
浊且玻璃管中有红色固体生成,则气体中同时含有CO与C02两种气体(或其他合理答
案).
13.已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283.0kJ/mol
则反应C(s)+O2(g)═CO2(g)的反应热为( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283.0kJ/mol
则反应C(s)+O2(g)═CO2(g)的反应热为( )
| A. | 172.5 kJ/mol | B. | -172.5 kJ/mol | C. | 393.5 kJ/mol | D. | -393.5 kJ/mol |
10.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为( )
| A. | N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H=38.6kJ•mol-1 | |
| D. | 不能确定 |
7.炽热的炉膛内有反应:C(s)+O2(g)═CO2(g)△H=-392KJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)═H2(g)+CO(g)△H=+131KJ/mol,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282KJ/mol,H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241KJ/mol,由以上反应推断往炽热的炉膛内通入水蒸气时( )
| A. | 既不能使炉火瞬间更旺,又不能节省燃料 | |
| B. | 虽不能使炉火瞬间更旺,但可以节省燃料 | |
| C. | 既能使炉火瞬间更旺又可以节省燃料 | |
| D. | 不能节省燃料,但能使炉火瞬间更旺 |
12.下列离子方程式书写正确的是( )
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
 或
或 .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+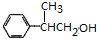 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$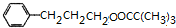 +H2O.
+H2O. .
.