题目内容
用KClO3氧化密度为1.19g/cm3,溶质的质量分数为36.5%的 HCl.反应方程式如下:KClO3+6HCl=KCl+3Cl2↑+3H2O
(1)试用双线桥表示出上述反应的电子转移情况.
(2)24.5g KClO3参与反应时,将有多少克HCl被氧化?此时产生的Cl2在标准状况下的体积为多少?
(1)试用双线桥表示出上述反应的电子转移情况.
(2)24.5g KClO3参与反应时,将有多少克HCl被氧化?此时产生的Cl2在标准状况下的体积为多少?
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,根据Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,标出电子的转移方向和数目;
(2)根据化学方程式计算参加反应的HCl的质量和氯气的体积.
(2)根据化学方程式计算参加反应的HCl的质量和氯气的体积.
解答:
解:(1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,双线桥法标出反应中电子得失数目为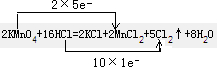 ,
,
答:双线桥法标出反应中电子得失数目为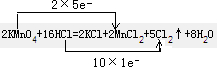 ;
;
(2)设24.5gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2.
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2×158 g 16×36.5 g 5×22.4 L
24.5 g x g y L
则 x=
=45.28(g),由原子守恒可知被氧化的为45.28g×
=28.3g,
y=
=8.68L,
答:24.5gKMnO4克反应HCl被氧化的质量为28.3g;产生的Cl2在标准状况下的体积为8.68L.
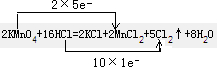 ,
,答:双线桥法标出反应中电子得失数目为
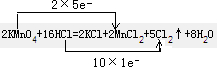 ;
;(2)设24.5gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2.
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2×158 g 16×36.5 g 5×22.4 L
24.5 g x g y L
则 x=
| 16×36.5×24.5 |
| 2×158 |
| 10 |
| 16 |
y=
| 5×22.4L×24.5g |
| 2×158g |
答:24.5gKMnO4克反应HCl被氧化的质量为28.3g;产生的Cl2在标准状况下的体积为8.68L.
点评:本题考查了氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,根据氧化还原反应中得失电子守恒进行分析解答即可.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
下列事实与结论相符且正确的是( )
| A、100 mL 0.1 mol?L-1AlCl3溶液中含有Al3+数目为0.01NA(NA代表阿伏加德罗常数) |
| B、Ksp(BaSO4)=1.07×10-10,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 |
| C、常温下,pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合,溶液pH<7 |
| D、0.1 mol?L-1 Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,23 g NO2 含有NA个氧原子 |
| B、常温常压下,Na2O2与足量H2O反应,共生成0.1 mol O2,转移电子的数目为0.4NA |
| C、常温常压下,22.4 L CCl4 含有NA个CCl4 分子 |
| D、1 mol Fe2+与足量的 H2O2 溶液反应,转移 2NA 个电子 |
把足量CO2通入下列饱和溶液中,最终会产生沉淀的是( )
| A、CaCl2 |
| B、Na2CO3 |
| C、Ca(OH)2 |
| D、NaCl |
 (主要产物),1mol某芳香烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如下面所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如下面所示的一系列变化.
