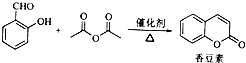
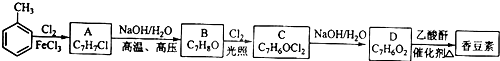
题目内容
(1)同温同压下,两种气体A和B的体积之比为2:1,质量之比为8:5,则A与B的密度之比为 ,摩尔质量之比为 .
(2)相同物质的量的O2和O3的质量比为 ,分子个数比为 ,所含氧原子的个数比为 .
(3)在200mL 2mol/L MgCl2溶液中,溶质的质量为 .此溶液中Mg2+的物质的量浓度为 ,Cl-的物质的量为 .
(2)相同物质的量的O2和O3的质量比为
(3)在200mL 2mol/L MgCl2溶液中,溶质的质量为
考点:阿伏加德罗定律及推论
专题:计算题
分析:(1)同温同压下,气体摩尔体积相等,气体的体积之比等于其物质的量之比,根据ρ=
=
计算其密度之比、摩尔质量之比;
(2)物质的量相等的O2和O3,根据m=nM、N=nNA及分子构成计算;
(3)氯化镁的质量m=CVM,该溶液中镁离子浓度与氯化镁浓度之比为1:1,氯离子浓度与氯化镁浓度之比为2:1.
| m |
| V |
| M |
| Vm |
(2)物质的量相等的O2和O3,根据m=nM、N=nNA及分子构成计算;
(3)氯化镁的质量m=CVM,该溶液中镁离子浓度与氯化镁浓度之比为1:1,氯离子浓度与氯化镁浓度之比为2:1.
解答:
解:(1)同温同压下,气体摩尔体积相等,气体的体积之比等于其物质的量之比,根据ρ=
=
:
=4:5,
根据ρ=
知,相同条件下,其密度之比等于摩尔质量之比=4:5,故答案为:4:5;4:5;
(2)物质的量相等的O2和O3,根据m=nM知,相同物质的量时其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3、根据N=nNA知,其分子数之比等于物质的量之比=1:1,分子数相等,根据分子构成知,其原子个数之比=2:3,
故答案为:2:3;1:1;2:3;
(3)氯化镁的质量m=CVM=2mol/L×0.2L×95g/mol=38g,该溶液中镁离子浓度与氯化镁浓度之比为1:1,所以镁离子浓度为2mol/L,氯离子浓度与氯化镁浓度之比为2:1,氯离子浓度为4mol/L,
故答案为:38g;2mol/L;4mol/L.
| m |
| V |
| 8 |
| 2 |
| 5 |
| 1 |
根据ρ=
| M |
| Vm |
(2)物质的量相等的O2和O3,根据m=nM知,相同物质的量时其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3、根据N=nNA知,其分子数之比等于物质的量之比=1:1,分子数相等,根据分子构成知,其原子个数之比=2:3,
故答案为:2:3;1:1;2:3;
(3)氯化镁的质量m=CVM=2mol/L×0.2L×95g/mol=38g,该溶液中镁离子浓度与氯化镁浓度之比为1:1,所以镁离子浓度为2mol/L,氯离子浓度与氯化镁浓度之比为2:1,氯离子浓度为4mol/L,
故答案为:38g;2mol/L;4mol/L.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系即可解答,注意气体摩尔体积的适用范围及适用条件,注意电解质溶液中离子浓度比较方法,题目难度不大.

练习册系列答案
相关题目
共价键的断裂有均裂和异裂两种方式.即:A:B→A?+B?,均裂; A:B→A++[:B]-,异裂.
下列化学方程式中发生共价键均裂的是( )
下列化学方程式中发生共价键均裂的是( )
| A、2K+2H2O=2KOH+H2↑ | |||
| B、2Na+2C2H5OH→2C2H5ONa+H2↑ | |||
| C、Na2CO3+H2O=NaHCO3+NaOH | |||
D、CH3COOH+CH3CH2OH
|
下面的排序不正确的是( )
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、硬度由大到小:金刚石>碳化硅>晶体硅 |
| C、熔点由高到低:Na>Mg>Al |
| D、离子键由强到弱:NaF>NaCl>NaBr>NaI |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、常温常压下,17g-14CH3所含的中子数为9NA |
| B、39g钾发生氧化还原反应时,一定失去NA个电子 |
| C、标准状况时,22.4L二氯甲烷所含有的分子数为NA |
| D、常温常压下,1mol氦气含有的核外电子数为 4NA |