题目内容
7.设NA表示阿伏加德罗常数的值,下列说法错误的是( )| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
分析 A、氧气和臭氧均由氧原子构成;
B、氯气和水的反应为可逆反应;
C、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$;
D、求出钠的物质的量,然后根据反应后钠元素为+1价来分析.
解答 解:A、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,故为2NA个,故A正确;
B、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故B错误;
C、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{11.2L}{22.4L/mol}{N}_{A}/mol$=0.5NA个,故C正确;
D、23g钠的物质的量为1mol,而反应后钠元素为+1价,故1mol转移1mol电子即NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
18.缓冲溶液可以抗御少量酸碱对溶液pH的影响.人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定.己知在人体正常体温时,反应H2CO3?HCO3-+H+的Ka=10-6.1mol•L-1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3.则下列判断正确的是( )
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
15.下列化学用语中,正确的是( )
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
19.为了得到3.9gAl(OH)3沉淀,可向含0.1molAlCl3的溶液中加入5mol/L的NaOH的体积为( )
| A. | 10ml | B. | 30ml | C. | 50ml | D. | 70ml |
16.硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g).
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
(2)反应2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡时的浓度比原来减小的是AC(填字母).
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
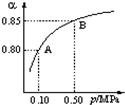
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
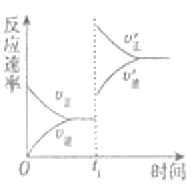
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.

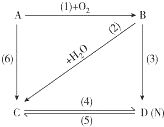 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式: 某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.
某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.