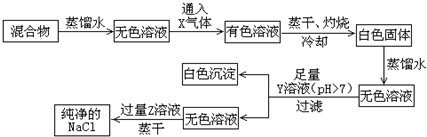
题目内容
11.下列反应中,属于加成反应的是( )| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 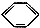 +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$ Br+HBr Br+HBr | |
| D. | CH2═CH2+Br2→CH2Br-CH2Br |
分析 A.乙烷中H被Cl取代;
B.乙醇失去H;
C.苯中H被Br取代;
D.碳碳双键断裂,与溴发生加成反应.
解答 解:A.CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl为取代反应;
B.2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O为氧化反应;
C. +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ Br+HBr为取代反应;
Br+HBr为取代反应;
D.CH2═CH2+Br2→CH2Br-CH2Br为加成反应,
故选D.
点评 本题考查化学反应方程式及有机反应,为高频考点,把握有机物的结构与性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.X、Y、Z、W、R五种短周期元素,原子序数依次增大.X原子是所有原子中半径最小的,Y、R同主族,Z、W、R 同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其原子的电子层数等于主族叙述,W单质是一种常见的半导体材料.下列税法正确的是( )
| A. | R的气态氢化物比W的气态氢化物更稳定 | |
| B. | Z的氧化物能与盐酸反应,不能与NaOH溶液反应 | |
| C. | 原子半径按X、R、W、Z、Y的顺序依次增大 | |
| D. | X、Y、Z的最高化合价数值均等于其主族序数 |
19.下列选项中,离子方程式书写正确的是( )
| A. | 向NaA1O2溶液中通入过量CO2:2A1O2-+CO2+3H2O═2Al (OH)3↓+CO32- | |
| B. | 钠与氢氧化钠溶液反应:2Na+2H2O═2Na++H2↑+2OH- | |
| C. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O═NH4++HSO3- | |
| D. | 向氯化铁溶液中插入铜片:2Fe3++Cu═2Fe+Cu2+ |
16.3He可以作为核聚变材料,以下关于3He的说法正确的是( )
| A. | 比4He少一个质子 | B. | 比4He多一个中子 | ||
| C. | 是4He的同素异形体 | D. | 是4He的同位素 |
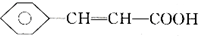 ),继而合成H的路线如下:
),继而合成H的路线如下: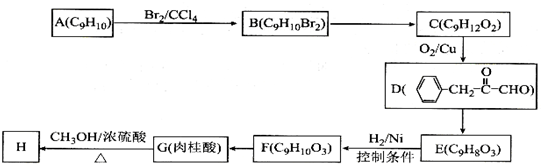
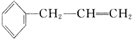 ,D中含有官能团的名称为羰基、醛基;
,D中含有官能团的名称为羰基、醛基; +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$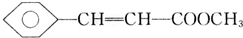 +H2O;
+H2O;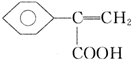 、
、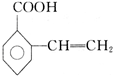 、
、 、
、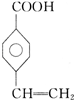 .
.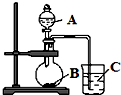 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.