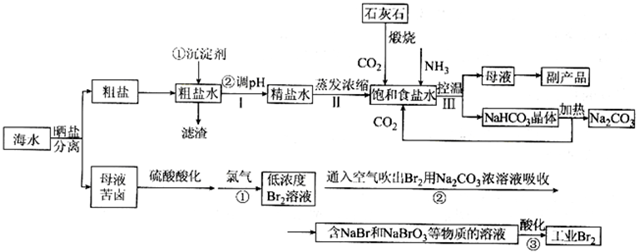
题目内容
16.3He可以作为核聚变材料,以下关于3He的说法正确的是( )| A. | 比4He少一个质子 | B. | 比4He多一个中子 | ||
| C. | 是4He的同素异形体 | D. | 是4He的同位素 |
分析 3He的质子数为2、质量数为3,4He的质子数为2、质量数为4,二者互为同位素,原子中质子数+中子数=质量数,以此来解答.
解答 解:A.二者质子数均为2,故A错误;
B.3He的中子数为1,4He的中子数为2,比4He少一个中子,故B错误;
C.同素异形体的分析对象为单质,而它们均为原子,故C错误;
D.与4He为质子数相同,中子数不同的原子,互为同位素,故D正确;
故选D.
点评 本题考查质子数、中子数、质量数的关系及同位素,明确原子的表示中不同位置数字的意义是解答的关键,注意概念的辨析,题目难度不大.

练习册系列答案
相关题目
6.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )
| A. | 阴离子的还原性:Y>X | |
| B. | Y和Z的简单阴离子都会破坏水的电离平衡 | |
| C. | 最高价氧化物的水化物的酸性:Z>Y | |
| D. | 氢化物的热稳定性:W>X |
11.下列反应中,属于加成反应的是( )
| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 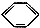 +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$ Br+HBr Br+HBr | |
| D. | CH2═CH2+Br2→CH2Br-CH2Br |
8.在一定温度下,电解某K2SO4饱和溶液,当阳极产生a mol气体时,溶液析出W g晶体(不含结晶水),则剩余溶液的质量分数为( )
| A. | $\frac{100W}{36a}$×100% | B. | $\frac{W}{36a+W}$×100% | C. | $\frac{W}{3600a+W}$×100% | D. | $\frac{100W}{36a+W}$×100% |
5.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
(1)推测反应III是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2-t4内 c(N2)的变化曲线.
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2-t4内 c(N2)的变化曲线.
6.下列说法(或实验),不正确的是( )
| A. | 丙烯与HBr加成得到的两种产物,无论通过核磁共振氢谱的吸收峰个数、还是峰面积之比,都可以进行区分 | |
| B. | 实验室制乙炔并探究其性质,需首先通过氢氧化钠,以去除去其中混有的硫化氢、磷化氢等酸性气体 | |
| C. | 利用溴乙烷的消去反应来制乙烯,并探究乙烯与高酸钾溶液反应的情况,需先通过水,防止其中可能混有的乙醇蒸汽干扰 | |
| D. | 乙酸、乙醇酯化反应实验:①使用浓硫酸做催化剂、吸水剂,②加热,及时蒸出乙酸乙酯,③适当过量的乙醇,都是在实验室条件下提高乙酸乙酯产率的方法 |
 .
. .
.