题目内容
20.NaCl样品中混有少量的CaCl2和NaBr,按下列程序操作可制得纯净的NaCl.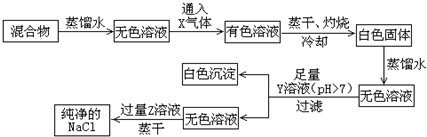
(1)X气体是Cl2,Y溶液是Na2CO3,Z溶液是盐酸.
(2)过滤时,除漏斗外还需要的玻璃仪器有烧杯、玻璃棒.
(3)加入Y溶液的目的是使溶液中的Ca2+形成CaCO3沉淀;若在不使用pH试纸的情况下,检验Y溶液是否足量的方法是(简要回答操作过程及现象)过滤前先静置,取上层澄清溶液,滴加少量Na2CO3溶液,无沉淀产生(或滴加少量盐酸有气泡产生),说明Y溶液是足量的.
分析 混合物溶于水,通入气体X可得有色溶液,说明生成溴,则X为Cl2,将溶液蒸干、灼烧得到白色固体含有氯化钠、氯化钙,加入蒸馏水溶解,然后加入足量的Y溶液,生成白色 沉淀,Y溶液的pH>7,应为Na2CO3,可与氯化钙反应生成CaCO3沉淀,滤液中加入过量盐酸,蒸干可得氯化钠,以此解答该题.
解答 解:混合物溶于水,通入气体X可得有色溶液,说明生成溴,则X为Cl2,将溶液蒸干、灼烧得到白色固体含有氯化钠、氯化钙,加入蒸馏水溶解,然后加入足量的Y溶液,生成白色 沉淀,Y溶液的pH>7,应为Na2CO3,可与氯化钙反应生成CaCO3沉淀,滤液中加入过量盐酸,蒸干可得氯化钠,
(1)由以上分析可知X为Cl2,Y为Na2CO3,Z为盐酸,故答案为:Cl2;Na2CO3;盐酸;
(2)过滤时,除漏斗外还需要的玻璃仪器有烧杯、玻璃棒,故答案为:烧杯、玻璃棒;
(3)混合物中含有氯化钙,加入碳酸钠,可使氯化钙生成沉淀,若在不使用pH试纸的情况下,检验Y溶液是否足量的方法是过滤前先静置,取上层澄清溶液,滴加少量Na2CO3溶液,无沉淀产生(或滴加少量盐酸有气泡产生),说明Y溶液是足量的,
故答案为:使溶液中的Ca2+形成CaCO3沉淀;过滤前先静置,取上层澄清溶液,滴加少量Na2CO3溶液,无沉淀产生(或滴加少量盐酸有气泡产生),说明Y溶液是足量的.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的原理和基本实验操作方法,难度不大.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
10.在含有大量H+、Fe3+、SO42-的溶液中,还能大量存在的离子是( )
| A. | CO32- | B. | Ba2+ | C. | SCN- | D. | NH4+ |
11.下列反应中,属于加成反应的是( )
| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 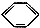 +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$ Br+HBr Br+HBr | |
| D. | CH2═CH2+Br2→CH2Br-CH2Br |
8.在一定温度下,电解某K2SO4饱和溶液,当阳极产生a mol气体时,溶液析出W g晶体(不含结晶水),则剩余溶液的质量分数为( )
| A. | $\frac{100W}{36a}$×100% | B. | $\frac{W}{36a+W}$×100% | C. | $\frac{W}{3600a+W}$×100% | D. | $\frac{100W}{36a+W}$×100% |
15.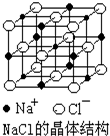 NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )
NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )
 NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )
NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )| A. | $\frac{0.585}{4{a}^{3}ρ}$ | B. | $\frac{5.85}{8{a}^{3}ρ}$ | C. | $\frac{58.5}{2{a}^{3}ρ}$ | D. | $\frac{58.5}{{a}^{3}ρ}$ |
5.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
(1)推测反应III是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2-t4内 c(N2)的变化曲线.
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2-t4内 c(N2)的变化曲线.
9.X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收.已知X是化石燃料燃烧的产物之一,是形成酸雨的主要物质;Y是一种黄绿色气体单质,其水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应.下列说法不正确的是( )
| A. | X是SO2,它既有氧化性又有还原性 | |
| B. | 干燥的气体Y不能使干燥的有色布条褪色,其水溶液具有漂泊作用的是HClO | |
| C. | Z与水反应的化学方程式为:3NO2+H2O=2HNO3+NO | |
| D. | 等物质的量的X与Y同时通入到湿润的有色布条上,有色布条褪色时间变短,漂泊效果增强 |
 =$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.
=$\frac{ax}{2}$mol,n(Cl2)=(1-x)a. 如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5mol•L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5mol•L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题: