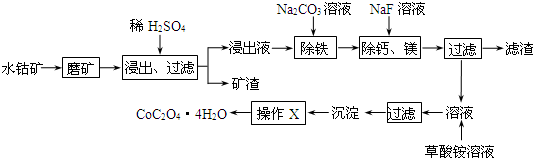
题目内容
下列电子式书写正确的是( )
A、溴化铵: |
B、硫化氢: |
C、氮气: |
D、羟基: |
考点:电子式
专题:
分析:A.溴化铵为离子化合物,电子式中需要标出阴阳离子所带电荷和阴阳离子的电子式;
B.硫化氢为共价化合物,不带电荷;
C.氮气分子中存在氮氮三键,应该存在3对共用电子对;
D.羟基中氢和氧共用一对电子.
B.硫化氢为共价化合物,不带电荷;
C.氮气分子中存在氮氮三键,应该存在3对共用电子对;
D.羟基中氢和氧共用一对电子.
解答:
解:A.溴化铵为离子化合物,溴离子需要标出最外层电子,溴化钠正确的电子式为 ,故A错误;
,故A错误;
B.硫化氢为共价化合物,不带电荷,正确的电子式为: ,故B错误;
,故B错误;
C.氮气分子中存在氮氮三键,应该存在3对共用电子对,氮气正确的电子式为 ,故C错误;
,故C错误;
D.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为 ,故D正确;
,故D正确;
故选D.
 ,故A错误;
,故A错误;B.硫化氢为共价化合物,不带电荷,正确的电子式为:
 ,故B错误;
,故B错误;C.氮气分子中存在氮氮三键,应该存在3对共用电子对,氮气正确的电子式为
 ,故C错误;
,故C错误;D.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为
 ,故D正确;
,故D正确;故选D.
点评:本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
相关题目
下列说法正确的是( )
| A、1 mol氧 |
| B、SO42-的摩尔质量是96 g |
| C、3 mol小麦 |
| D、标准状况下,1 mol O2 |
能正确表示下列化学反应的离子方程式是( )
| A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
| D、向碳酸氢钠溶液中滴加少量稀硝酸:CO32-+2H +=CO2↑ +H2O |
用蒸馏水稀释0.1mol/L醋酸时,始终保持增大趋势的是( )
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
下列各组数据中,前者刚好是后者两倍的是( )
| A、2mol水的摩尔质量和1 mol水的摩尔质量 |
| B、200mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 1 mol/L氯化钾溶液中c(Cl-) |
| C、64g二氧化硫中的氧原子数和标准状况下22.4L二氧化碳中的氧原子数 |
| D、2mol/LBa(OH)2溶液中Ba2+的物质的量和OH-的物质的量 |