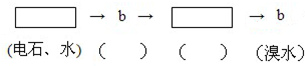题目内容
水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO,从水钴矿中提取钴的主要工艺流程如下:
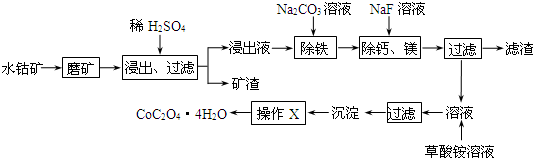
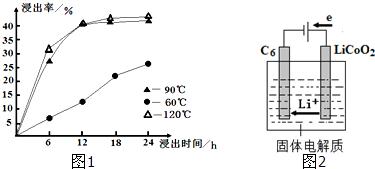
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图1所示.考虑生产成本和效率,最佳的
浸出时间为 小时.
(2)请配平下列除铁的化学方程式:Fe2(SO4)3+H2O+Na2CO3═Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF═MgF2↓+Na2SO4;CaSO4+2NaF═CaF2↓+Na2SO4.已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的
= .
(4)“沉淀”中含杂质离子主要有SO42-、F-、 和 ;“操作X”包括洗涤和 .其中判断沉淀洗涤干净的方法为: .
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图2所示).电池反应为 LiCoO2+C6
CoO2+LiC6,写出该电池放电时的正极反应式 .

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图1所示.考虑生产成本和效率,最佳的
浸出时间为

(2)请配平下列除铁的化学方程式:Fe2(SO4)3+H2O+Na2CO3═Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF═MgF2↓+Na2SO4;CaSO4+2NaF═CaF2↓+Na2SO4.已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的
| c(Ca2+) |
| c(Mg2+) |
(4)“沉淀”中含杂质离子主要有SO42-、F-、
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图2所示).电池反应为 LiCoO2+C6
| 充电 |
| 放电 |
考点:物质分离和提纯的方法和基本操作综合应用,原电池和电解池的工作原理
专题:实验设计题
分析:(1)根据浸出率与时间和温度的关系及生产成本分析;
(2)根据原子守恒配平方程式;
(3)
=
;
(4)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质,检验硫酸根离子是否存在检验;
(5)放电时,该电池是原电池,正极上得电子发生还原反应.
(2)根据原子守恒配平方程式;
(3)
| c(Ca2+) |
| c(Mg2+) |
| Ksp(CaF2) |
| Ksp(MgF2) |
(4)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质,检验硫酸根离子是否存在检验;
(5)放电时,该电池是原电池,正极上得电子发生还原反应.
解答:
解:(1)根据图知,时间越长浸出率越高,温度越高,浸出率越高,但浸出12小时后,浸出率变化不大,90℃和120℃浸出率变化不大,且时间过长、温度过高导致成本较大,所以最佳的浸出时间为12小时;
故答案为:12;
(2)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑;
故答案为:3,6,6,1,5,6;
(3)
=
=
=1.5;
故答案为:1.5;
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有铵根离子和钠离子,所以沉淀上含有铵根离子和钠离子,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,判断沉淀洗涤干净的方法为:取最后一次洗涤液于试管中,滴加盐酸酸化,再加氯化钡,若无沉淀生成则洗涤干净;
故答案为:NH4+;Na+;干燥;取最后一次洗涤液于试管中,滴加盐酸酸化,再加氯化钡,若无沉淀生成则洗涤干净;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,故答案为:CoO2+Li++e-=LiCoO2.
故答案为:12;
(2)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑;
故答案为:3,6,6,1,5,6;
(3)
| c(Ca2+) |
| c(Mg2+) |
| Ksp(CaF2) |
| Ksp(MgF2) |
| 1.1×10-10 |
| 7.40×10-11 |
故答案为:1.5;
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有铵根离子和钠离子,所以沉淀上含有铵根离子和钠离子,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,判断沉淀洗涤干净的方法为:取最后一次洗涤液于试管中,滴加盐酸酸化,再加氯化钡,若无沉淀生成则洗涤干净;
故答案为:NH4+;Na+;干燥;取最后一次洗涤液于试管中,滴加盐酸酸化,再加氯化钡,若无沉淀生成则洗涤干净;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,故答案为:CoO2+Li++e-=LiCoO2.
点评:本题考查难溶电解质的溶解平衡、电极反应式的书写、物质的分离和提纯等知识点,难点是(3)题,明确溶度积常数的含义是解此题关键,电极反应式的书写是学习难点,要结合电解质溶液的酸碱性书写,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在强酸性溶液中能大量共存的无色透明离子组是( )
| A、K+、Na+、NO3-、MnO4- |
| B、Mg2+、Na+、Cl-、SO42- |
| C、K+、Na+、Br-、Cu2+ |
| D、Na+、Ba2+、OH-、SO42- |
下列电子式书写正确的是( )
A、溴化铵: |
B、硫化氢: |
C、氮气: |
D、羟基: |
下列实验基本操作中不正确的是( )
| A、用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平 |
| B、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并搅拌 |
| C、用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 |
| D、用托盘天平称量物质时,称量物放在左盘,砝码放在右盘 |
 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验: 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.