题目内容
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
请回答:
(1)用 滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(2)滴定到终点时溶液由 色变成 色.
(3)烧碱样品的纯度为 .
(4)若出现下列情况,测定结果偏高的是 .
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
f.酸式滴定管滴定至终点后,发现尖嘴处有气泡(原无气泡)
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(1)用
(2)滴定到终点时溶液由
(3)烧碱样品的纯度为
(4)若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
f.酸式滴定管滴定至终点后,发现尖嘴处有气泡(原无气泡)
考点:中和滴定
专题:实验题
分析:(1)盐酸显酸性,应用碱式滴定管盛装0.10mol/L的盐酸标准液;
(2)滴加几滴酚酞的NaOH溶液显红色,当滴定到终点时,溶液显中性,溶液变为无色;
(3)根据滴定原理进行分析;
(4)根据c(NaOH)=
进行误差分析.
(2)滴加几滴酚酞的NaOH溶液显红色,当滴定到终点时,溶液显中性,溶液变为无色;
(3)根据滴定原理进行分析;
(4)根据c(NaOH)=
| c(HCl)×V(HCl) |
| V(NaOH) |
解答:
解:(1)盐酸显酸性,应用酸式滴定管盛装0.10mol/L的盐酸标准液;故答案为:酸式;
(2)滴加几滴酚酞的NaOH溶液显红色,当滴定到终点时,溶液显中性,溶液变为无色;故答案为:红色、无色;
(3)用0.10mol/L的标准盐酸滴定三次,消耗盐酸的平均体积为
mL=20.00mL,
HCl→NaOH
1 1
0.10mol/L×20mL n(NaOH),解之得n(NaOH)=0.002mol,
则烧碱样品的纯度为
×100%=80%;故答案为;80%;
(4)根据c(NaOH)=
进行误差分析a.滴定前用蒸馏水冲洗锥形瓶,结果无影响;
b.在振荡锥形瓶时不慎将瓶内溶液溅出,结果偏低;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,需要更多的盐酸,结果偏高;
d.酸式滴定管滴至终点对,俯视读数,盐酸读数偏小,结果偏低;
e.酸式滴定管用蒸馏水洗后,未用标准液润洗,需要更多的盐酸,结果偏高;
f.酸式滴定管滴定至终点后,发现尖嘴处有气泡(原无气泡);所用盐酸体积偏小,结果偏低;.
故选ce.
(2)滴加几滴酚酞的NaOH溶液显红色,当滴定到终点时,溶液显中性,溶液变为无色;故答案为:红色、无色;
(3)用0.10mol/L的标准盐酸滴定三次,消耗盐酸的平均体积为
| 20.10+20.00+19.90 |
| 3 |
HCl→NaOH
1 1
0.10mol/L×20mL n(NaOH),解之得n(NaOH)=0.002mol,
则烧碱样品的纯度为
| 0.002mol×10×40g/mol |
| 1g |
(4)根据c(NaOH)=
| c(HCl)×V(HCl) |
| V(NaOH) |
b.在振荡锥形瓶时不慎将瓶内溶液溅出,结果偏低;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,需要更多的盐酸,结果偏高;
d.酸式滴定管滴至终点对,俯视读数,盐酸读数偏小,结果偏低;
e.酸式滴定管用蒸馏水洗后,未用标准液润洗,需要更多的盐酸,结果偏高;
f.酸式滴定管滴定至终点后,发现尖嘴处有气泡(原无气泡);所用盐酸体积偏小,结果偏低;.
故选ce.
点评:本题考查NaOH的质量分数的测定,解题的关键是明确滴定原理及有关应用,难度中等.

练习册系列答案
相关题目
若某氖原子的质量是a g,一个12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A、该氖原子的相对原子质量可以表示为
| ||
| B、该氖原子的相对原子质量可以表示为aNA | ||
C、W g该氖原子的物质的量一定是
| ||
| D、12b=NA |
下列电子式书写正确的是( )
A、溴化铵: |
B、硫化氢: |
C、氮气: |
D、羟基: |
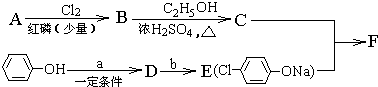
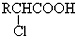 ,
,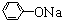 +RCl→
+RCl→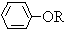 +NaCl
+NaCl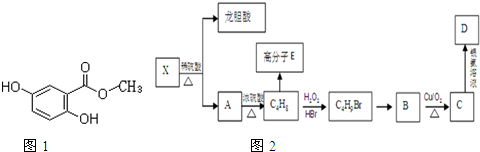
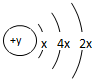 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空: