题目内容
用蒸馏水稀释0.1mol/L醋酸时,始终保持增大趋势的是( )
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,以此解答.
解答:
解:醋酸是弱电解质,溶液中存在电离平衡,稀释醋酸溶液,促进醋酸电离,但醋酸增大的电离程度小于溶液体积增大程度,
A.醋酸增大的电离程度小于溶液体积增大程度,所以c(CH3COO-)减小,故A错误;
B.醋酸增大的电离程度小于溶液体积增大程度,所以c(H+)减小,故B错误;
C.温度不变,醋酸的电离平衡常数不变,故C错误;
D.加水稀释醋酸促进醋酸电离,但醋酸增大的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度减小,温度不变水的离子积常数不变,所以c(OH-)增大,故D正确.
故选:D.
A.醋酸增大的电离程度小于溶液体积增大程度,所以c(CH3COO-)减小,故A错误;
B.醋酸增大的电离程度小于溶液体积增大程度,所以c(H+)减小,故B错误;
C.温度不变,醋酸的电离平衡常数不变,故C错误;
D.加水稀释醋酸促进醋酸电离,但醋酸增大的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度减小,温度不变水的离子积常数不变,所以c(OH-)增大,故D正确.
故选:D.
点评:本题考查了弱电解质电离,侧重于学生的分析能力的考查,明确弱电解质电离特点是解本题关键,注意结合水的离子积常数分析,知道水的离子积常数只与温度有关,与溶液的酸碱性无关,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列电子式书写正确的是( )
A、溴化铵: |
B、硫化氢: |
C、氮气: |
D、羟基: |
使用酸碱中和滴定的方法,用0.1000mo1?L-1盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作会使测定结果偏低的是( )
| A、用酸式滴定管量取0.1000 mol?L-1盐酸时,酸式滴定管经蒸馏水洗净后未用0.1000mo1?L-1盐酸润洗 |
| B、滴定前平视读数,滴定结束时俯视读数 |
| C、滴定前滴定管下端尖嘴没有气泡,滴定后读数时发现滴定管下端尖嘴有气泡 |
| D、用未知浓度的Na0H待测液润洗锥形瓶 |
 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空: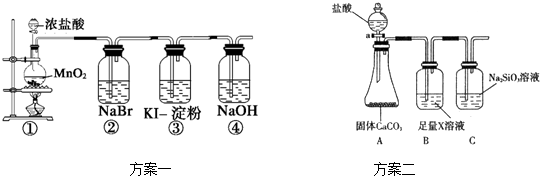
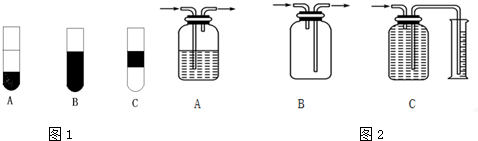
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.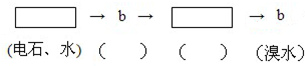
 的名称是
的名称是 的分子式是
的分子式是