题目内容
18.向60mLNa2SO4溶液中加入BaCl2溶液,有关数据见表:| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 20 | 40 | 100 | 120 |
| 沉淀质量/g | 0 | 0.233 | m | 0.699 | 0.699 |
| A. | 混合前,Na2SO4溶液的物质的量浓度为0.05mol/L | |
| B. | 混合前,BaCl2溶液的物质的量浓度为0.10mol/L | |
| C. | 3号实验中沉淀的质量m为0.398g | |
| D. | 完全沉淀60mLNa2SO4溶液消耗BaCl2溶液的体积为80mL |
分析 发生Na2SO4+BaCl2=BaSO4↓+2NaCl,由表格中的数据可知,生成沉淀最多为0.699g,n(BaSO4)=$\frac{0.699g}{233g/mol}$=0.003mol;2号实验中n(BaSO4)=$\frac{0.233g}{233g/mol}$=0.001mol,则实验3号中,m为实验2中的2倍,以此来解答.
解答 解:A.由表格中的数据可知,生成沉淀最多为0.699g,n(BaSO4)=$\frac{0.699g}{233g/mol}$=0.03mol,则Na2SO4溶液的物质的量浓度为$\frac{0.003mol}{0.06L}$=0.05mol/L,故A正确;
B.003mol2号实验中n(BaSO4)=$\frac{0.233g}{233g/mol}$=0.001mol,混合前,BaCl2溶液的物质的量浓度为$\frac{0.001mol}{0.02L}$=0.05mol/L,故B错误;
C.实验3号中,m为实验2中的2倍,则m=0.233g×2=0.466g,故C错误;
D.完全沉淀60mL Na2SO4溶液消耗BaCl2溶液的体积为$\frac{0.003mol}{0.05mol/L}$=0.06L=60mL,故D错误;
故选A.
点评 本题考查化学反应的计算,把握发生的化学反应及反应中的物质的量关系、表格中数据分析为解答的关键,侧重分析能力、计算能力的考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.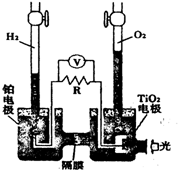 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将电能转化为化学能 | |
| B. | 铂电极上发生的反应为:2H++2e-=H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
6.下列离子方程式正确的是( )
| A. | 氯化铁腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 实验室制氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| C. | 稀硫酸中加氢氧化钡到溶液呈中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| D. | 氢氧化钠溶液中吸收少量二氧化硫:2OH-+SO2═SO32-+H2O |
13.某同学在实验报告中记录了下列数据,其中正确的是( )
| A. | 用25 mL量筒量取12.36 mL盐酸 | |
| B. | 用pH试纸测出某溶液pH为3.5 | |
| C. | 用托盘天平称取8.75 g食盐 | |
| D. | 用酸式滴定管测出消耗盐酸的体积为15.60 mL |
10.阿伏加德罗常数用NA表示,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 4.4g二氧化碳气体中所含的原子个数与4.2g氮气中所含的原子个数不相等 | |
| C. | 常温常压下,11.2LNH3所含的原子数目为2NA | |
| D. | 常温常压下,48gO3含有的氧原子数为3 NA |
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
 .
.