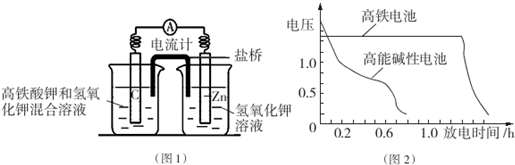
题目内容
3.工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下: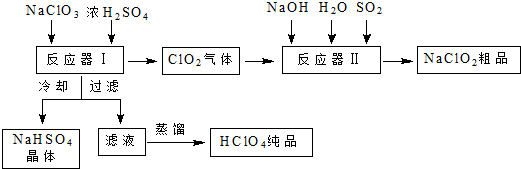
已知:
①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出.
②高氯酸是至今为止人们已知酸中的最强酸,沸点90℃.
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O,冷却的目的是降低NaHSO4的溶解度,使NaHSO4结晶析出.
(2)反应器Ⅱ中发生反应的离子方程式为2ClO2+SO2+4OH-═2ClO2-+SO42-+2H2O.
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是H2O2有还原性也能把ClO2还原为NaClO2.
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,请写出工业上生产漂白粉的离子方程式:Cl2+Ca(OH)2=ClO-+Cl-+Ca2++H2O.
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.ClO2的有效氯含量为2.63g.(结果保留两位小数)
分析 NaClO3和浓H2SO4在反应器I中反应:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;生成HClO4、ClO2和NaHSO4,ClO2在反应器II中与二氧化硫、氢氧化钠反应2ClO2+SO2+4NaOH═2NaClO2+Na2SO4+2H2O;生成亚氯酸钠,再得到其晶体;反应器I中得到的溶液通过冷却过滤得到NaHSO4晶体,滤液为HClO4,蒸馏得到纯净的HClO4.
(1)NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4;冷却溶液时会析出NaHSO4晶体;高氯酸易挥发,蒸馏可以得到高氯酸;
(2)反应器Ⅱ中ClO2与二氧化硫、氢氧化钠反应生成亚氯酸钠;
(3)H2O2具有还原性,能还原ClO2;
(4)具有强氧化性的物质能用作消毒剂和漂白剂,氯气和NaOH溶液生成NaCl和次氯酸钠、水.
解答 解:(1)NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4,其反应的化学方程式为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;冷却溶液时会降低NaHSO4的溶解度,使NaHSO4结晶析出;高氯酸的沸点低,易挥发,蒸馏可以得到纯净的高氯酸,
故答案为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;降低NaHSO4的溶解度,使NaHSO4结晶析出;
(2)反应器Ⅱ中ClO2与二氧化硫、氢氧化钠反应生成亚氯酸钠,其反应的离子方程式为:2ClO2+SO2+4OH-═2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-═2ClO2-+SO42-+2H2O;
(3)H2O2中O元素为-1价,有还原性,能被强氧化剂氧化,H2O2能还原ClO2,所以入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2;
故答案为:H2O2有还原性也能把ClO2还原为NaClO2;
(4)工业上用氯气和石灰乳生产漂白粉,其反应的离子方程式为:Cl2+Ca(OH)2=ClO-+Cl-+Ca2++H2O,
故答案为:Cl2+Ca(OH)2=ClO-+Cl-+Ca2++H2O;
(5)1gClO2的物质的量$\frac{1g}{67.5g/mol}$=$\frac{1}{67.5}$mol,依据电子转移数目相等,ClO2~Cl-~5e-,Cl2~2Cl-~2e-,可知氯气的物质的量为$\frac{1}{67.5}$mol×5×$\frac{1}{2}$=$\frac{5}{135}$mol,则氯气的质量为$\frac{5}{135}$mol×71g/mol=2.63g,
故答案为:2.63g.
点评 本题以亚氯酸钠制备为背景,考查了学生阅读题目获取信息的能力、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力,以及在新情境下综合运用知识解决问题的能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 氯化铵与氢氧化钙混合加热:NH4++OH-=NH3↑+H2O | |
| B. | 铁片溶于足量稀硝酸:Fe+2H+=Fe2++H2↑ | |
| C. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ | |
| D. | 稀氨水与稀盐酸混合:NH3?H2O+H+=NH4++H2O |
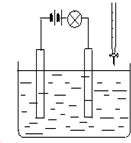 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 醋酸中逐渐加入氢氧化钠溶液 |
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 20 | 40 | 100 | 120 |
| 沉淀质量/g | 0 | 0.233 | m | 0.699 | 0.699 |
| A. | 混合前,Na2SO4溶液的物质的量浓度为0.05mol/L | |
| B. | 混合前,BaCl2溶液的物质的量浓度为0.10mol/L | |
| C. | 3号实验中沉淀的质量m为0.398g | |
| D. | 完全沉淀60mLNa2SO4溶液消耗BaCl2溶液的体积为80mL |
| A. | Cu和足量的稀硝酸反应产生4.48 L气体时,转移的电子数为0.6×6.02×1023 | |
| B. | 常温常压下,8.8 g CO2和N2O混合物中所含有的原子总数为0.6×6.02×1023 | |
| C. | 标准状况下,3.36 L己烷中含有的分子数目为0.15×6.02×1023 | |
| D. | 在1 L 0.2 mol/L的硫酸铁溶液中含有的三价铁离子数为0.4×6.02×1023 |