题目内容
5. 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.(1)已知H3AsO3是两性偏酸性的化合物,则H3AsO3中As的化合价为+3.它与硫酸反应时生成盐的化学式为As2(SO4)3.NaHAsO3溶液呈碱性,原因是HAsO32-+H2O?H2AsO3-+OH-(用离子方程式表示),该溶液中c(H2AsO3-)>C(AsO33-)(填“>”、“<”或“=”).
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.
①工业上以雄黄为原料制备砷的过程是先在空气中煅烧使其转化为砒霜(As2S3),然后用焦炭还原,写出煅烧时发生反应的化学方程式:As4S4+7O2$\frac{\underline{\;高温\;}}{\;}$2As2O3+4SO2.砒霜有剧毒,卫生防疫分析中鉴定砷的方法是先将试样与锌、硫酸混合在一起反应,将生成的气体(AsH3)导入到热玻璃管中,根据玻璃管产生的现象判断试样中是否含有砷的化合物,写出砒霜转化为AsH3的化学方程式:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O.
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为1:10.
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性.
①常温下砷酸的K1=6×10-3、K2=1×10-7,则0.6mol/L的砷酸溶液中c(H+)约为0.06mol/L.
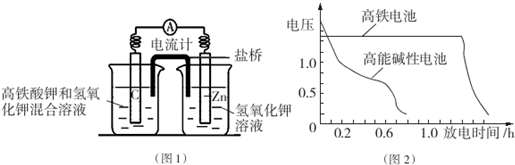
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O═AsO33-+I2+2OH-.当P池中溶液由无色变成蓝色时,正极上的电极反应式为AsO43-+H2O+2e-=AsO33-+2OH-.当电流计指针归中后向Q池中加入一定量的NaOH,则电子由Q(填“P”或“Q”)池中的电流流出.
分析 (1)根据化合物中元素的化合价的代数和为零计算;根据As的化合价判断生成硫酸盐的化学式;NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解;HAsO32-在溶液中电离程度小于水解程度;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫;As2O3与锌、硫酸混合反应生成AsH3和硫酸锌、水;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,根据化合价的变化分析;
(3)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=$\frac{c({H}_{2}As{{O}_{4}}^{-})c({H}^{+})}{c({H}_{3}AS{O}_{4})}$,以第一步电离为主;
②电池总反应为AsO43-+2I-+H2O?AsO33-+I2+2OH.当P池中溶液由无色变成蓝色时,说明P池发生的是负极氧化反应,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,据此可写出电极反应方程式,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,电子应由负极流向正极.
解答 解:(1)H3AsO3中O为-2价,H为+1价,As的化合价为+3价;As的化合价为+3价,硫酸根离子的化合价为-2价,则硫酸盐的化学式As2(SO4)3;NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解,其水解方程式为:;HAsO32-在溶液中电离程度小于水解程度,以水解为主,水解生成H2AsO3-,则该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:+3;As2(SO4)3;HAsO32-+H2O?H2AsO3-+OH-;>;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫,反应的化学方程式为:As4S4+7O2$\frac{\underline{\;高温\;}}{\;}$2As2O3+4SO2;As2O3与锌、硫酸混合反应生成AsH3和硫酸锌、水,其反应的方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
故答案为:As4S4+7O2$\frac{\underline{\;高温\;}}{\;}$2As2O3+4SO2;As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,As的化合价从+3价升高到+5价,S的化合价从-2价升高到0价,N的化合价从+5价降低到+4价,则反应中还原剂与氧化剂物质的量之比为1:10;
故答案为:1:10;
(3)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=$\frac{c({H}_{2}As{{O}_{4}}^{-})c({H}^{+})}{c({H}_{3}AS{O}_{4})}$,以第一步电离为主,则c(H+)≈$\sqrt{{K}_{1}×c({H}_{3}AS{O}_{4})}$=$\sqrt{6×1{0}^{-3}×0.6}$=0.06mol/L;
故答案为:0.06;
②P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出;
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
点评 本题以As及其化合物的性质为知识背景,涉及水解平衡与电离平衡、氧化还原反应的分析与计算、原电池原理及平衡的移动等,属基础考综合应用的考查,难度中等,对提高学生分析问题解决问题的能力培养有一定帮助.

| A. | 氯化钠 | B. | 硫酸钙 | C. | 硫酸镁 | D. | 氯化镁 |
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 20 | 40 | 100 | 120 |
| 沉淀质量/g | 0 | 0.233 | m | 0.699 | 0.699 |
| A. | 混合前,Na2SO4溶液的物质的量浓度为0.05mol/L | |
| B. | 混合前,BaCl2溶液的物质的量浓度为0.10mol/L | |
| C. | 3号实验中沉淀的质量m为0.398g | |
| D. | 完全沉淀60mLNa2SO4溶液消耗BaCl2溶液的体积为80mL |

已知:Ⅰ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.能否用新制氯水代替双氧水能(填“能”或“否”).
(3)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为EG.
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去.
(6)步骤⑥中,洗涤氯化锶晶体最好选用D.
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液.
| A. | 检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 | |
| B. | 为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们 | |
| C. | 可以用SO2来漂白纸浆、毛、丝、草帽辫等 | |
| D. | “硫磺”温泉可以医治皮肤病 |