题目内容
4.下列叙述正确的是( )| A. | 氟单质与水反应的化学方程式为F2+H2O═HF+HFO | |
| B. | 碱金属单质在空气中燃烧的生成物都是过氧化物 | |
| C. | x原子的最外层电子数比y原子的少,能说明金属x比金属y的活泼性强 | |
| D. | HCl气体溶于水的过程中,共价键被破坏 |
分析 A、F2和水反应生成HF和O2;
B、锂燃烧生成氧化锂;
C、元素的金属性与最外层电子数的多少和电子层数有关;
D、一般非金属元素之间形成共价键,由共价键形成的物质在溶于水、化学变化中共价键被破坏.
解答 解:A、F2氧化性很强,能和水发生置换反应生成氧气,所以氟气与水反应的化学方程式为:2F2+2H2O═4HF+O2,故A错误;
B、锂燃烧生成氧化锂,碱金属单质在空气中燃烧的生成物不都是过氧化物,故B错误;
C、元素的金属性与最外层电子数的多少和电子层数有关,即最外层电子数少的,金属性不一定强,如Ca的金属性大于Na,故C错误;
D、HCl气体溶于水,在水分子的作用下发生电离,共价键被破坏,故D正确.
故选D.
点评 本题考查常见物质的性质和共价键的特点,明确共价键被破坏的常见方式是解答本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
①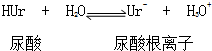 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)
下列对反应②叙述中正确的是( )
①
 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)下列对反应②叙述中正确的是( )
| A. | 反应的△H>0 | B. | 反应的△H=0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
12.某溶液中在25℃时由水电离出的氢离子浓度1×10-13 mol•L-1,下列说法正确的是( )
| A. | HCO3-离子在该溶液中一定不能大量共存 | |
| B. | 该溶液的pH一定是13 | |
| C. | 向该溶液中加入铝片后,一定能生成氢气 | |
| D. | 若该溶液的溶质只有一种,它一定是酸或碱 |
9.下列实验错误的是( )
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的Fe(NO3)3杂质 | |
| B. | 在物质提纯操作中不能用乙醇从碘水中萃取碘 | |
| C. | 向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
16.X~R是元素周期表中的短周期元素,其性质或结构信息如表:
请回答下列问题:
(1)X在元素周期表中的位置是第三周期ⅦA族
(2)元素W的离子结构示意图为
(3)元素R的最高价氧化物的电子式为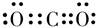
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为离子键、极性键
(5)含Y的某化合物的水溶液呈酸性,可净水.起净水作用的物质为Al(OH)3胶体
(6)W的氢氧化物是重要的基本化工原料.
工业上用电解饱和NaCl溶液制取该氢氧化物,生产中副产物有C12、H2 (写化学式)
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
(1)X在元素周期表中的位置是第三周期ⅦA族
(2)元素W的离子结构示意图为
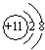
(3)元素R的最高价氧化物的电子式为
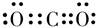
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为离子键、极性键
(5)含Y的某化合物的水溶液呈酸性,可净水.起净水作用的物质为Al(OH)3胶体
(6)W的氢氧化物是重要的基本化工原料.
工业上用电解饱和NaCl溶液制取该氢氧化物,生产中副产物有C12、H2 (写化学式)
13.将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是( )
| A. | Cu2+和Fe2+ | B. | H+和Cu2+ | C. | Fe2+和Mg2+ | D. | Fe3+和Fe2+ |
14.下列各组离子在加入Na2O2后能大量共存的是( )
| A. | K+、H+、NO3-、SO32- | B. | CO32-、Cl-、Fe2+、NH4+- | ||
| C. | Cu2+、Cl-、SO42-、K+ | D. | Ba2+、K+、NO3-、Cl- |
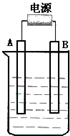 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: