题目内容
14.下列各组离子在加入Na2O2后能大量共存的是( )| A. | K+、H+、NO3-、SO32- | B. | CO32-、Cl-、Fe2+、NH4+- | ||
| C. | Cu2+、Cl-、SO42-、K+ | D. | Ba2+、K+、NO3-、Cl- |
分析 A.硝酸根离子在酸性条件下能够氧化亚硫酸根离子;
B.碳酸根离子与亚铁离子发生双水解反应;
C.过氧化钠与水反应生成氢氧化钠、氧气,铜离子与氢氧化钠反应生成氢氧化铜沉淀;
D.四种离子之间不反应,加入过氧化钠后也不反应.
解答 解:A.H+、NO3-、SO32-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.CO32-、Fe2+之间发生双水解反应,在溶液中不能大量共存,故B错误;
C.Na2O2与水反应生成氢氧化钠和氧气,Cu2+与氢氧化钠反应生成氢氧化铜沉淀,在溶液中不能大量共存,故C错误;
D.Ba2+、K+、NO3-、Cl-之间不反应,加入后也不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列叙述正确的是( )
| A. | 氟单质与水反应的化学方程式为F2+H2O═HF+HFO | |
| B. | 碱金属单质在空气中燃烧的生成物都是过氧化物 | |
| C. | x原子的最外层电子数比y原子的少,能说明金属x比金属y的活泼性强 | |
| D. | HCl气体溶于水的过程中,共价键被破坏 |
5.如图所示的实验操作中,正确的是( )
| A. |  检查容量瓶是否漏水 | B. |  给液体加热 | ||
| C. |  滴加液体 | D. |  过滤 |
2.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中不正确的是( )
| A. | M为H2O | |
| B. | SnCl62-是氧化产物 | |
| C. | 还原性:As>SnCl2 | |
| D. | 每生成1molAs,反应中转移电子的物质的量为3mol |
9.1mol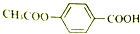 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
19.下列反应的离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向Al2(SO4)3溶液中加入过量NH3?H2O:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| C. | 酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+═Cl2↑+3H2O | |
| D. | 向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-═2Na++SO42-+OH- |
6.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A. | 4 v(NH3)=5 v(O2) | B. | 5v(O2)=6 v(H2O) | C. | 2 v(NH3)=3 v(H2O) | D. | 4v(O2)=5 v(NO) |
3.巴黎气候大会揭开了发展低碳经济的宏伟序幕,下列有关说法正确的是( )


| A. | 太阳能、地热能、核能、化石燃料等均属于“新能源” | |
| B. | 减少含碳物质做燃料符合“低碳”理念 | |
| C. | 图中转化途径不能体现“节能减排”的思想 | |
| D. | 节约用电不能减少CO2的排放量 |
4. CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)下列有关CO2说法不正确额是b(填字母)
a.CO2属于酸性氧化物
b.CO2是导致酸雨发生的主要原因
c.可用Na2CO3溶液捕捉(吸收)CO2
d.使用氢能源替代化石燃料可减少CO2排放
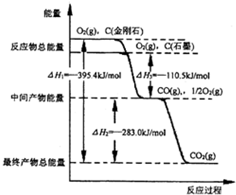
(2)金刚石和石墨燃烧反应中的能量变化如图所示.
①在通常情况下,金刚石和石墨中,石墨(填“金刚石”或“石墨”)更稳定.
②CO的燃烧热为283.0kJ•mol-1.
③石墨不完全燃烧生成CO的热化学方程式为C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体.
已知某些化学键能数据如下表:
已知CO中的键为C≡O,则工业制备甲醇的热化学方程式为CO(g)+2H2 (g)?CH3OH(g)△H=-116kJ/mol.
 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)下列有关CO2说法不正确额是b(填字母)
a.CO2属于酸性氧化物
b.CO2是导致酸雨发生的主要原因
c.可用Na2CO3溶液捕捉(吸收)CO2
d.使用氢能源替代化石燃料可减少CO2排放
(2)金刚石和石墨燃烧反应中的能量变化如图所示.
①在通常情况下,金刚石和石墨中,石墨(填“金刚石”或“石墨”)更稳定.
②CO的燃烧热为283.0kJ•mol-1.
③石墨不完全燃烧生成CO的热化学方程式为C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体.
已知某些化学键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |