题目内容
5.某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化.(1)该同学最初的实验操作和现象等如表:
| 编号 | 操作 | 现象等 |
| Ⅰ | 先向2mL 0.1mol/L FeC12溶液中滴加KSCN溶液,再滴加新制氯水 | ①滴加KSCN溶液后,溶液无明显变化;滴加新制氯水后,溶液变变成红色 ②FeC12溶液与新制氯水反应的离子方程式2Fe2++Cl2═2Fe3++2Cl- |
| Ⅱ | 先向2mL 0.1mol/L FeC13溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 | 滴加KSCN溶液后,溶液变红色;滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象等 |
| Ⅲ | 先向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加KSCN溶液 | 滴加FeC13溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变为红色.根据实验现象可以推测出Fe3+有可能与I-发生了氧化还原反应. |
(4)该同学认为需要进一步设计实验证明根据实验Ⅲ中现象得出的结论.请填补表中的实验内容.
| 编号 | 操作 | 现象及结论 |
| Ⅳ | 向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加①再滴加淀粉溶液(或CCl4;或铁氰化钾溶液) | 现象:溶液变蓝. 结论:Fe3+能与I-发生氧化还原反应生成②I2,③Fe2+ |
分析 (1)Ⅰ.亚铁离子和硫氰化钾溶液不反应,但亚铁离子有还原性,能被氯气氧化生成铁离子,铁离子和硫氰根离子反应生成血红色的络合物,导致溶液呈血红色;
(2)碘水溶液呈黄色,生成了碘单质,说明发生了氧化还原反应;
(3)碘离子和铁离子发生氧化还原反应且参加反应的Fe3+与I-的物质的量相同,再结合得失电子数相等确定反应方程式;
(4)如果碘离子和铁离子反应生成亚铁离子和碘单质,根据亚铁离子的特征反应或碘单质的特征反应进行实验,碘遇淀粉溶液变蓝色、碘溶于四氯化碳后溶液呈紫色,亚铁离子和铁氰化钾溶液反应生成蓝色沉淀.
解答 解:(1)Ⅰ.①亚铁离子和硫氰化钾溶液不反应,所以向氯化亚铁溶液中滴加硫氰化钾溶液后,溶液不呈红色,再滴加氯水后,氯气把亚铁离子氧化呈铁离子,铁离子和硫氰化钾溶液反应生成络合物,导致溶液呈血红色,所以实验I的现象为滴加KSCN后溶液无明显变化,加入氯水后溶液变成红色,
故答案为:无明显变化;变成红色;
②氯化亚铁和氯气反应生成氯化铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(2)碘水溶液呈黄色,根据溶液变成黄色,推测生成了I2,说明发生了氧化还原反应,
故答案为:氧化还原;
(3)Fe3+与I-发生氧化还原反应,且参加反应的Fe3+与I-的物质的量相同,所以该反应的离子方程式为:2Fe3++2I-?2Fe2++I2,
故答案为:2Fe3++2I-?2Fe2++I2;
(4)如果碘离子和铁离子发生氧化还原反应生成碘单质和亚铁离子,亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,碘单质遇淀粉溶液变蓝色,碘溶于四氯化碳后溶液呈紫色,所以如果要检验碘单质和亚铁离子,可以用再滴加淀粉溶液(或CCl4;或铁氰化钾溶液)检验,
反应现象为:溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),
得出结论为:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+),
故答案为:
| 编号 | 操作 | 预期现象及结论 |
| IV | 再滴加淀粉溶液(或CCl4;或铁氰化钾溶液) | I2;Fe2+ |
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确铁离子和亚铁离子的性质及检验方法为解答关键,注意掌握实验方案设计与评价的原则,试题培养了学生的分析能力及化学实验能力.

 智慧小复习系列答案
智慧小复习系列答案| A. | 甲苯苯环上的一个氢原子被-C3H7的烷基取代 | |
| B. | C5H12被C12取代生成的一氯代物 | |
| C. | 与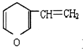 互为同分异构体的芳香族化合物 互为同分异构体的芳香族化合物 | |
| D. | 菲( 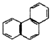 )的一硝基取代物 )的一硝基取代物 |
| A. | 热化学方程式:H2(g)+F2(g)=2HF(g)△H=-270 kJ,表示的意义为2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 | |
| B. | 用pH试纸测定1 mol/L的醋酸溶液,显示的pH为2~3能证明醋酸为弱电解质 | |
| C. | 为减少洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | pH计是精确测定溶液pH的仪器 |
| A. | 碳酸氢钠俗称苏打 | |
| B. | 鉴别Na2CO3和NaHCO3两种无色溶液,可以分别滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| C. | NaHCO3的热稳定性大于Na2CO3 | |
| D. | 向滴有酚酞试剂的水中加入足量的Na2O2粉末并振荡,溶液由无色变红最后又变无色 |
| A. | 4和5 | B. | 5和4 | C. | 4和6 | D. | 6 和4 |
| A. | 放热反应在常温下均能自发进行 | |
| B. | 原电池工作时所发生的反应一定有氧化还原反应 | |
| C. | 加热时,化学反应只向吸热反应方向进行 | |
| D. | 化学平衡常数的表达式与化学反应方程式的书写无关 |
| A. | 可用水来鉴别苯和CCl4 | |
| B. | 煤的干馏属于化学变化,硝化反应、酯化反应、皂化反应都属于取代反应 | |
| C. | CH2Cl2有两种同分异构体 | |
| D. | 高温加热能杀死病毒是因为构成病毒的蛋白质受热变性 |
| A. | 实验室中常用饱和食盐水除去Cl2中混有的HCl | |
| B. | 银器长期放置,表面变暗 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | 氨水中加酸,NH4+的浓度增大 |
| A. | 氯化氢的比例模型: | B. | Cl-的结构示意图: | ||
| C. | 氯乙烯的结构简式:CH2=CHCl | D. | HClO的电子式: |