题目内容
8.化学兴趣小组的同学利用下图所示装置进行某些气体的制备、性质等实验(图中夹持装置有省略)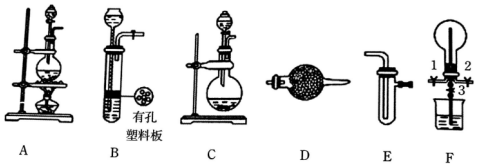
请回答下列问题:
(1)根据上述实验装置,用MnO2和浓盐酸制备纯净、干燥的Cl2,可选用的发生、净化装置连接顺序为A→E→接E,第一个E装置的药品是饱和食盐水.
(2)根据上述实验装置,为制备干燥NH3,可选用的发生、净化装置为C接D.其中发生装置中可以选用的药品为a(填选项字母)
a.碱石灰和浓氨水 b.浓H2SO4和浓氨水 c.碱石灰和氯化铵 d.生石灰和氯化铵
(3)一定条件下,Cl2 与CH4在装置F中发生反应,其有机物有CH3Cl、CH2Cl2、CHCl3和CCl4.(填化学式)
(4)利用装置F可探究Cl2和NH3的反应.
已知Cl2与NH3可发生反应:3Cl+2NH3=N2+6HCl,实验时打开开关1、3,关闭2,先向烧瓶中通入Cl2,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的NH3.
①不能先通入NH3的原因:氨气易溶于水,如果先通入氨气,容易产生喷泉,对实验造成干扰.
②试验一段时间后烧瓶内出现的现象为:黄绿色逐渐变浅甚至消失,有白烟产生.
③装置F中烧杯内发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O.
④请设计一个实验方案(操作过程、实验现象)鉴定烧瓶内最终固体产物的阳离子,其方案为:取少量固体于试管中,加入适量浓NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝;[或用蘸有浓盐酸(或浓硝酸)的玻璃棒放在试管口,若有白烟生成]..
分析 (1)实验室用加热固体二氧化锰、浓盐酸制取氯气,制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
(2)浓氨水与生石灰不需要加热产生氨气,要制取氨气应连接盛有碱石灰的干燥管干燥氨气;
(3)甲烷与氯气发生取代反应,生成产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳;
(4)氨气易溶于水,如果先通入氨气,容易产生喷泉,对实验造成干扰,实验时打开开关1、3,关闭2向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的氨气,实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,反应生成氯化铵;装置F中氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;可根据铵根离子与碱反应生成氨气的方法检验.
解答 解:(1)实验室用加热固体二氧化锰、浓盐酸制取氯气,制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,所以可选用的发生、净化装置为A接E、接E,第一个E装置的药品是饱和食盐水;
故答案为:A;饱和食盐水;
(2)C装置是不需要加热制备氨气的装置,浓氨水以挥发,滴入生石灰即可产生氨气,制取干燥氨气可以用碱石灰干燥氨气;为制取干燥氨气,可将装置C连接D点的干燥的氨气,装置C中的烧瓶内固体宜选用碱石灰或者生石灰;
故答案为:C;D; a;
(3)甲烷与氯气发生取代反应,生成产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳,化学式为:CH3Cl、CH2Cl2、CHCl3和CCl4;
故答案为:CH3Cl、CH2Cl2、CHCl3和CCl4;
(4)①氨气易溶于水,如果先通入氨气,容易产生喷泉,对实验造成干扰;
故答案为:氨气易溶于水,如果先通入氨气,容易产生喷泉,对实验造成干扰;
②实验时打开开关1、3,关闭2向烧瓶中通入氯气,然后关闭1、3,打开2,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的氨气,实验一段时间后,反应消耗氯气,所以烧瓶内出现黄绿色逐渐变浅甚至消失,有白烟产生;
故答案为:黄绿色逐渐变浅甚至消失,有白烟产生;
③装置F中氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
④检验铵根离子,可取少量固体于试管中,加入适量浓NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,[或用蘸有浓盐酸(或浓硝酸)的玻璃棒放在试管口,若有白烟生成],证明固体中有NH4+,
故答案为:取少量固体于试管中,加入适量浓NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝;[或用蘸有浓盐酸(或浓硝酸)的玻璃棒放在试管口,若有白烟生成];
点评 本题考查综合考查物质的性质,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目涉及氨气、氯气、乙烯气体的制备及性质的检验,熟悉制备原理和物质的性质是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | H2SO4(浓)+C | B. | Fe3O4+Al | C. | Cl2+Mg | D. | NO2+H2O |
| 坩埚质量 | 坩埚+试样 | 失水后,坩埚+试样 |
| 11.70g | 20.82g | 16.50g |
| A. | 晶体中含不挥发杂质 | B. | 未做恒重操作 | ||
| C. | 加热前晶体未研磨 | D. | 加热时有晶体溅出 |
| A. | 稀有气体化学性质很稳定 | B. | 硝酸易挥发,而硫酸难挥发 | ||
| C. | 氮气的化学性质比氧气稳定 | D. | 常温常压下,溴呈液态,碘呈固态 |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,该反应为放热反应(填吸热或放热). 若增大压强,则平衡常数A(填序号).
A.一定不变 B.一定减小 C.一定增大 D.增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是BC.
A.容器中压强不变B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)D.c(CO)=c(CO2)
| A. | 粮食酿酒 | B. | 酒精挥发 | C. | 牛奶变酸 | D. | 石油裂解 |