题目内容
3.测定CuSO4•xH2O晶体的x值,数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )| 坩埚质量 | 坩埚+试样 | 失水后,坩埚+试样 |
| 11.70g | 20.82g | 16.50g |
| A. | 晶体中含不挥发杂质 | B. | 未做恒重操作 | ||
| C. | 加热前晶体未研磨 | D. | 加热时有晶体溅出 |
分析 根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值,在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水,都会造成测量结果偏高、偏低,结合x的理论值为5.0,进行分析解答.
解答 解:由表格中的数据,硫酸铜晶体的质量为:20.82g-11.70g=9.12g,结晶水的质量为:20.82g-16.50g=4.32g,
则CuSO 4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O,
160+18x 18x
9.12g 4.32g
解得x=8>5,测定结果偏大,
A.硫酸铜晶体中含不挥发杂质,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故A错误;
B.未做恒重操作,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故B错误;
C.加热前晶体未研磨,测定的结晶水质量偏小,则测定结果偏小,故C错误;
D.加热过程中有少量晶体溅出,导致水的质量测定结果偏大,故D正确;
故选D.
点评 本题考查硫酸铜晶体中结晶水的测定,题目难度不大,明确实验操作方法为解答关键,注意分析误差时从导致加热前后的质量差进行判断,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
13.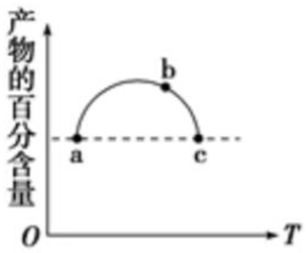 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )| A. | a、b、c三点均为平衡点 | |
| B. | a、c两点的反应速率相同 | |
| C. | b点对应温度的平衡常数大于c点对应温度的平衡常数 | |
| D. | a、c两点体系的压强相同 |
14.下列离子方程式正确的是( )
| A. | 硫化钠溶液显碱性:S2-+H2O═HS-+OH- | |
| B. | 硫酸铜溶液呈酸性:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| C. | 氯化铝溶液与碳酸钠溶液混合:Al3++CO32-═Al(OH)3↓+H2↑ | |
| D. | 在饱和氯化铵溶液中撒入镁粉后微热:2NH4++Mg═Mg2++2NH3↑+H2↑ |
15.下列说法不正确的是( )
| A. | 用酚酞溶液可区别苯酚钠溶液与福尔马林 | |
| B. | 用溴水可区别丙烯与丙烯酸 | |
| C. | 用新制的Cu(OH)2悬浊液可区别醋酸与乙醇 | |
| D. | 无法用溴水除去苯中溶有的少量苯酚 |
12.在相同条件下0.1mol/L的氢氧化钠溶液和0.1mol/L的盐酸中,水的电离程度( )
| A. | 一样大 | B. | 后者大 | C. | 前者大 | D. | 无法确定 |
1.缩小容器容积,增大压强,下列反应所建立的平衡向左移动的是( )
| A. | 2NO2(g)?N2O4 | B. | N2(g)+3H2(g)?2NH3(g) | C. | C(s)+O2(g)?2CO(g) | D. | H2(g)+I2(g)?2HI(g) |