题目内容
18.10mL 1mol/L的NaOH溶液稀释成100mL,所得溶液中NaOH的物质的量浓度为多少?分析 稀释过程中NaOH的物质的量不变,根据c=$\frac{n}{V}$计算出所得溶液中NaOH的物质的量浓度.
解答 解:10mL 1mol/L的NaOH溶液稀释成100mL,所得溶液中NaOH的物质的量浓度为:c(NaOH)=$\frac{1mol/L×0.01L}{0.1L}$=0.1mol/L,
答:所得溶液中NaOH的物质的量浓度为0.1mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确稀释定律的内容为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列仪器中,不能加热的是( )
| A. | 烧瓶 | B. | 烧杯 | C. | 容量瓶 | D. | 蒸发皿 |
11.下列有关化学用语表示正确的是( )
| A. | 氨气分子的电子式: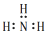 | B. | Mg2+结构示意图  | ||
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U互为同位素 | D. | 乙醇的分子式C2H5OH |
6.对下列实验现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 酸性KMnO4溶液中加入H2O2溶液,产生气体 | KMnO4催化H2O2分解产生O2 |
| B | 光亮的铁片放在浓硝酸中浸泡一段时间后取出,用蒸馏水中冲洗后放入CuSO4溶液,无明显现象 | 铁片在浓硝酸中发生钝化,表面生成致密的氧化膜 |
| C | 向废FeCl3蚀刻液X中加入少量铁粉,振荡,得到澄清透明的溶液 | X中一定不含Cu2+ |
| D | 分别在盛有相同浓度ZnSO4、CuSO4溶液的试管中通入足量H2S气体,后者有黑色沉淀 | KSP(ZnS)<KSP(CuS) |
| A. | A | B. | B | C. | C | D. | D |
13.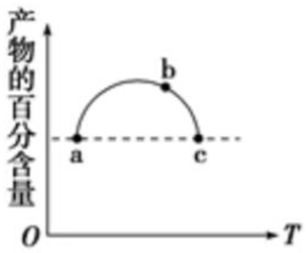 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
 在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )
在恒容容器中充入一定量的SO2和Cl2,发生反应SO2(g)+Cl2(g)?SO2Cl2(g),测得体系中产物的百分含量与反应温度的变化如图所示,下列说法正确的是( )| A. | a、b、c三点均为平衡点 | |
| B. | a、c两点的反应速率相同 | |
| C. | b点对应温度的平衡常数大于c点对应温度的平衡常数 | |
| D. | a、c两点体系的压强相同 |
3.下列反应中,CO2作氧化剂的是( )
| A. | Ca(OH)2+CO2=CaCO3↓+H2O | B. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO | ||
| C. | 2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ | D. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2+CO2 |
7.在恒容密闭容器中充入2mol气体X和3mol气体Y发生反应:2X(g)+3Y(g)?4Z(g)△H=-akJ•mol-1,达到平衡时,下列描述一定正确的是( )
| A. | 各物质的浓度之比c(X):c(Y):c(Z)=2:3:4 | B. | 消耗2molX,同时消耗4molZ | ||
| C. | 混合气体的密度保持不变 | D. | 反应放出akJ热量 |