题目内容
6.(1)除去铁粉中的少量铝粉的试剂是氢氧化钠溶液,离子方程为2Al+2OH-+2H2O=2AlO2-+3H2↑.(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是盐酸,离子方程式为HCO3-+H+=CO2↑+H2O.
(3)除去Na2CO3粉末中混入的NaHCO3杂质用加热方法,化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑.
分析 (1)铝能够溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,而Fe不反应;
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是HCl,碳酸氢钠和HCl反应生成氯化钠;
(3)采用加热的方法除去碳酸钠中的碳酸氢钠.
解答 解:(1)铝能够溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,除去铁粉中混有的铝粉可以选择氢氧化钠溶液,
故答案为:氢氧化钠溶液; 2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是盐酸,碳酸氢钠和HCl反应生成氯化钠,离子方程式为:HCO3-+H+=CO2↑+H2O,
故答案为:盐酸;HCO3-+H+=CO2↑+H2O;
(3)碳酸氢钠不稳定,受热易分解生成碳酸钠,所以采用加热的方法除去碳酸钠中的碳酸氢钠,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑.
点评 本题以除杂、物质的用途为载体考查了物质的性质,难点是除杂剂的选取,根据物质和杂质之间的不同点结合物质的性质选取合适的除杂剂,题目难度中等.

练习册系列答案
相关题目
9.中国传统文化对人类文明贡献巨大,古化文献中充分记载了古代化学研究成果.下列关于KNO3的古代文献,对其说明不合理的是( )
.
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| C | 鉴别 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| D | 提纯 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| A. | A | B. | B | C. | C | D. | D |
1.缩小容器容积,增大压强,下列反应所建立的平衡向左移动的是( )
| A. | 2NO2(g)?N2O4 | B. | N2(g)+3H2(g)?2NH3(g) | C. | C(s)+O2(g)?2CO(g) | D. | H2(g)+I2(g)?2HI(g) |
18.有关下列图象的分析正确的是( )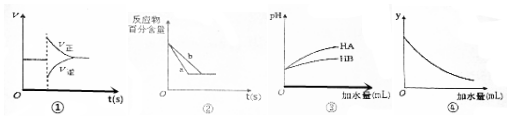

| A. | 图①表示在N2(g)+3H2(g)?2NH3(g)达到平衡后,减少NH3浓度时速率的变化 | |
| B. | 图②中a、b曲线分别表示反应H2(g)+I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 图③说明HB是比HA更弱的酸 | |
| D. | 图④中的y表示将冰醋酸加水稀释时溶液导电能力的变化情况 |
16.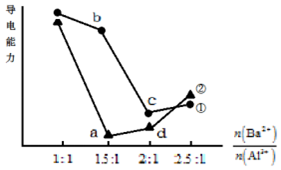 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )| A. | ①代表加入KAl(SO4)2的变化曲线 | |
| B. | a点溶液的pH值约为7 | |
| C. | b点溶液中大量存在的阳离子有Al3+和Ba2+ | |
| D. | c、d两点溶液中Ba(OH)2均已完全反应 |
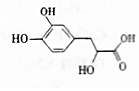 丹参素可用于祛瘀止痛、凉血消痈、养血安神.其结构简式如图.
丹参素可用于祛瘀止痛、凉血消痈、养血安神.其结构简式如图.