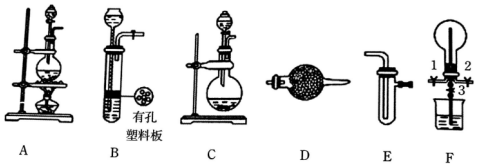
题目内容
20.在一恒定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,该反应为放热反应(填吸热或放热). 若增大压强,则平衡常数A(填序号).
A.一定不变 B.一定减小 C.一定增大 D.增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是BC.
A.容器中压强不变B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)D.c(CO)=c(CO2)
分析 (1)根据化学平衡常数的概念来书写,平衡常数=$\frac{生成物平衡浓度幂次方的积}{反应物平衡浓度幂次方乘积}$;根据温度对化学平衡、化学平衡常数的影响来回答,平衡常数随温度升高增大,说明平衡正向进行,据此判断反应物;化学平衡常数只受温度的影响,改变压强后平衡常数不变;
(2)化学平衡状态的标志:正逆反应速率相等,各组分含量保持不变,据此进行判断.
解答 解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,CO(g)+H2O(g)?CO2(g)+H2(g)反应的平衡常数为:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;
化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数减小,说明化学平衡逆向移动,则正反应为放热反应;
化学平衡常数只与温度有关,与压强大小无关,所以增大压强后平衡常数不变,
故答案为:$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;放热;A;
(2)A.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,不能根据压强判断平衡状态,故A错误;
B.混合气体中c(CO)不变,表明正逆反应速率相等,达到了平衡状态,故B正确;
C、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故C正确;
D、c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,故D错误;
故答案为:BC.
点评 本题考查了化学平衡常数的计算,题目难度中等,明确化学平衡常数的概念及表达式为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

| A. | 用酚酞溶液可区别苯酚钠溶液与福尔马林 | |
| B. | 用溴水可区别丙烯与丙烯酸 | |
| C. | 用新制的Cu(OH)2悬浊液可区别醋酸与乙醇 | |
| D. | 无法用溴水除去苯中溶有的少量苯酚 |
| 选项 | 实验 | 现象 | 由现象所得结论 |
| A | 将Cl2通入品红溶液 | 品红褪色 | Cl2具有漂白性 |
| B | 分别测量饱和NaCO3、饱和NaHCO3溶液的pH | pH值:碳酸钠>碳酸氢钠 | 水解能力:CO32->HCO3- |
| C | 将CO2通入CaCl2的溶液中 | 无明显现象 | 酸性:盐酸>碳酸 |
| D | 观察铁块、铝箔在潮湿空气中的腐蚀情况 | 铁块生锈,而铝箔几乎无变化 | 在潮湿空气中铁比铝要活泼 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 一样大 | B. | 后者大 | C. | 前者大 | D. | 无法确定 |
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| C | 鉴别 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| D | 提纯 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| A. | A | B. | B | C. | C | D. | D |
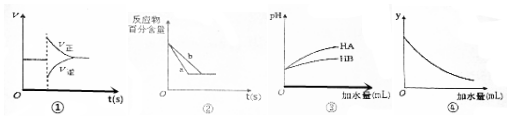
| A. | 图①表示在N2(g)+3H2(g)?2NH3(g)达到平衡后,减少NH3浓度时速率的变化 | |
| B. | 图②中a、b曲线分别表示反应H2(g)+I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 图③说明HB是比HA更弱的酸 | |
| D. | 图④中的y表示将冰醋酸加水稀释时溶液导电能力的变化情况 |