题目内容
18.由乙炔、苯、乙醛组成的混合物,经测定其中碳元素质量分数为36%,则混合物中氧元素的质量分数为( )| A. | 44% | B. | 54.22% | C. | 39.12% | D. | 无法计算 |
分析 乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,进一步看作CH与H2O的混合物,先利用C的质量分数来计算CH的质量分数,然后得到H2O的质量分数,再根据水的化学式O元素质量分数.
解答 解:乙醛(C2H4O)可以表示为C2H2.H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C2H2、H2O的混合物,C6H6、C2H2的最简式为CH,进一步看作CH与H2O的混合物,C元素的质量分数为36%,则CH的质量分数为36%÷$\frac{12}{13}$=39%,故H2O的质量分数为1-39%=61%,故O元素质量分数=61%×$\frac{16}{18}$=54.22%,
故选B.
点评 本题考查混合物中元素质量分数的计算,难度中等,关键是根据乙醛的化学式将物质转化为最简式为CH与水的混合物.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
8. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
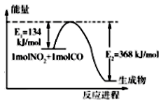
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如表所示:
已知:破坏1molN2(g)和3molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量.
①则T1<T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率v(H2)=0.2mol•L-1•min-1.
平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:N2+8H++6e-═2NH4+.
(4)已知室温下当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/K的氨水,用甲基橙做指示剂达到终点时所用盐酸的量应是大于5mL.(填“大于”、“小于”或“等于”),此时溶液中离子浓度大小顺序为c (Cl-)>c(NH4+)>c(H+)>c(OH-).
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1<T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率v(H2)=0.2mol•L-1•min-1.
平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:N2+8H++6e-═2NH4+.
(4)已知室温下当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/K的氨水,用甲基橙做指示剂达到终点时所用盐酸的量应是大于5mL.(填“大于”、“小于”或“等于”),此时溶液中离子浓度大小顺序为c (Cl-)>c(NH4+)>c(H+)>c(OH-).
9.应用元素周期律分析,下列推断正确的是( )
| A. | 砹(At)是第VIIA族元素,其氢化物的穆定性大于HCl | |
| B. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 |
6.广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是( )
| A. | BaO2的水解产物是Ba(OH)2和H2O2 | B. | PCl3水解的产物是HClO和PH3 | ||
| C. | CaC2水解的产物是Ca(OH)2和C2H2 | D. | Al2S3水解的产物是Al(OH)3和H2S |
10.下列叙述正确的是( )
| A. | 向蒸馏水中滴加浓硫酸的过程中,Kw保持不变 | |
| B. | 酸与碱溶液恰好完全反应时所得溶液一定呈中性 | |
| C. | 向醋酸钠溶液中加入少量冰醋酸,水的电离度减小 | |
| D. | 广泛pH试纸能够测出溶液的精确pH |
7.下列反应的离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 将过量氨水加入AlCl3溶液中:Al3++4OH-═AlO2-+2H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 向NaHCO3溶液中加入等物质的量的Ca(OH)2:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
8.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在容积为2L的密闭容器中进行.在2s内用NH3浓度的减少来表示的平均反应速率为0.3mol•L-1•s-1,在2s时,H2O增加的物质的量为( )
| A. | 1.8mol | B. | 1.2mol | C. | 0.9mol | D. | 0.8mol |
 有光学活性,发生下列反应:
有光学活性,发生下列反应: