题目内容
7.下列反应的离子方程式书写正确的是( )| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 将过量氨水加入AlCl3溶液中:Al3++4OH-═AlO2-+2H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 向NaHCO3溶液中加入等物质的量的Ca(OH)2:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
分析 A.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
B.一水合氨为弱碱,离子方程式中不能拆开,且反应生成氢氧化铝沉淀;
C.酸性条件下碘酸根离子与碘离子反应生成碘单质;
D.二者物质的量相等时,氢氧根离子过量,飞跃生成碳酸钙沉淀、氢氧化钠和水.
解答 解:A.氯气溶于水生成氯化氢和次氯酸,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故A错误;
B.一水合氨不能拆开,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.酸性溶液中KIO3与KI反应生成I2,反应的离子方程式为:IO3-+5I-+6H+═3I2+3H2O,故C正确;
D.向NaHCO3溶液中加入等物质的量的Ca(OH)2,碳酸氢根离子完全转化成碳酸钙沉淀,正确的离子方程式为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
18.由乙炔、苯、乙醛组成的混合物,经测定其中碳元素质量分数为36%,则混合物中氧元素的质量分数为( )
| A. | 44% | B. | 54.22% | C. | 39.12% | D. | 无法计算 |
15.下列实验操作与相应的现象或结论均正确的是( )
| 选项 | 实验操作 | 现象或结论 |
| A | 将铁屑、溴水、苯混合加热 | 制取溴苯 |
| B | 先加入浓硫酸,再加入苯,最后滴入浓硝酸 | 制取硝基苯 |
| C | 向C6H5ONa溶液巾通入CO2气体 | 溶液出现浑浊,证明酸性:C6H5OH<H2CO3 |
| D | 乙醇和浓硫酸混合加热,将产生的气体通人酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色,证明乙醇发生消去反应生成乙烯 |
| A. | A | B. | B | C. | C | D. | D |
2.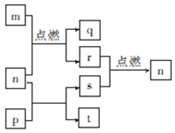 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:Z>Y | |
| B. | 化合物p中只存在离子键 | |
| C. | 图示转化关系涉及的反应均为氧化还原反应 | |
| D. | 最简单气态氢化物的稳定性:W>X |
12.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述不正确的是( )
| A. | W、X、Y、Z最外层电子数之和为20 | B. | WX2、YX2和ZX2均只含共价键 | ||
| C. | 原子半径的大小顺序为X<W<Y<Z | D. | Z的气态氢化物比Y的稳定 |
19.下列各组物质中化学键的类型完全相同的是( )
| A. | NH4Cl H2O CO2 | B. | NaCl MgCl2 Na2O | ||
| C. | H2O Na2O CO2 | D. | CaCl2 NaOH H2SO4 |
16.可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
| A. | 溴水、氯化铁溶液 | B. | 溴水、酸性高锰酸钾溶液 | ||
| C. | 氯化铁溶液、碳酸钠溶液 | D. | 氯化铁溶液、酸性高锰酸钾溶液 |
17.欲除去下列物质中混有的少量杂质(括号内物质为杂质),错误的是( )
| A. | 苯(苯酚):氢氧化钠溶液,充分震荡静止后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入氢氧化钠溶液,充分震荡静止后,分液 | |
| D. | 乙酸(乙醇):加入金属钠,蒸馏 |
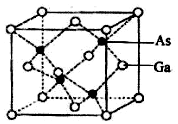 氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题:
氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题: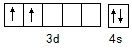 ,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.
,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.