题目内容
9.应用元素周期律分析,下列推断正确的是( )| A. | 砹(At)是第VIIA族元素,其氢化物的穆定性大于HCl | |
| B. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 |
分析 A.元素的非金属性越强,气态氢化物的稳定性越强;
B.根据元素周期表中同主族元素性质的变化规律来分析;
C.氨气溶于水,其溶液显碱性;
D.根据元素周期表中同周期元素性质的变化规律来比较金属性,金属性越强,则最高价氧化物对应水化物的碱性越强.
解答 解:A.第VIIA族Cl元素的非金属性大于砹的非金属性,则砹的氢化物的稳定性小于HCl,故A错误;
B.铊(Tl)与铝同主族,随原子序数的增大,金属性增强,则金属性Tl>Al,则Tl能与酸反应,但不与氢氧化钠溶液反应,故B错误;
C.第二周期非金属元素N,其氢化物为氨气,氨气溶于水,水溶液为碱性,故C错误;
D.第三周期金属元素随原子序数的增大金属性减弱,金属性Na>Mg>Al,则金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱,故D正确.
故选D.
点评 本题考查元素周期表和元素周期律,为高频考点,把握同周期和同主族元素的性质变化规律、金属性与非金属性强弱的比较方法是解答本题的关键,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
20.关于碱金属单质的性质叙述错误的是( )
| A. | 都能够在空气中剧烈燃烧 | |
| B. | 都能够与水反应生成碱和H2 | |
| C. | 都可以保存在煤油中 | |
| D. | 都是密度比较小、熔点比较低的金属 |
4.下列实验方法不能达到实验目的是( )
| A. | 用品红溶液鉴别SO2和CO2两种气体 | |
| B. | 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| C. | 加热可除去Na2CO3固体中少量的NaHCO3 | |
| D. | 向某溶液中先加少量氯水,再滴加KSCN溶液后变红,则原溶液中一定含有Fe2+ |
18.由乙炔、苯、乙醛组成的混合物,经测定其中碳元素质量分数为36%,则混合物中氧元素的质量分数为( )
| A. | 44% | B. | 54.22% | C. | 39.12% | D. | 无法计算 |
19.下列各组物质中化学键的类型完全相同的是( )
| A. | NH4Cl H2O CO2 | B. | NaCl MgCl2 Na2O | ||
| C. | H2O Na2O CO2 | D. | CaCl2 NaOH H2SO4 |
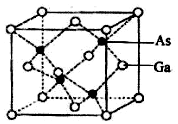 氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题:
氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题: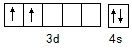 ,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.
,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.