题目内容
1.短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y原子基态时最外层电子数是次外层的3倍,Z是短周期中最活泼的金属元素,W与Y属于同一主族.下列叙述正确的是( )| A. | 原子半径:W>Z>Y | |
| B. | 元素Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 元素W最高价氧化物的水化物为强酸 | |
| D. | 化合物从X2Y、Z2Y中化学键的类型相同 |
分析 X是周期表中原子半径最小的元素,应为H元素,Y原子最外层电子数是次外层电子数的3倍,应为O元素,W与Y处于同一族,应为S元素,元素Z是短周期中最活泼的金属元素,应为Na元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:X是周期表中原子半径最小的元素,应为H元素,Y原子最外层电子数是次外层电子数的3倍,应为O元素,W与Y处于同一族,应为S元素,元素Z是短周期中最活泼的金属元素,应为Na元素,
A.同周期元素从左到右,原子半径逐渐减小,原子核外电子层数越多,半径越大,应为Z>W>Y>X,故A错误;
B.非金属性O<S,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.元素W最高价氧化物的水化物为硫酸,为二元强酸,故C正确;
D.化合物从X2Y、Z2Y中化学键分别属于共价键、离子键,故D错误.
故选C.
点评 本题考查原子结构与元素周期律知识,为高考常见题型,侧重于学生的分析能力的考查,难度中等,注意把握原子结构特征和对应单质、化合物的性质,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
12.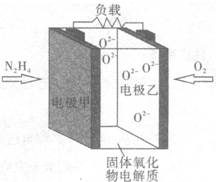 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为N2H4+2O2═2NO+2H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
16.X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子M层有1个电子,Y原子最外层电子数为最内层电子数的2倍,Z元素的最高化合价为最低化合价绝对值的3倍.下列叙述正确的是( )
| A. | 原子半径Z>X>Y | |
| B. | 最高价氧化物的水化物酸性强弱W>Z>Y | |
| C. | 简单气态氢化物的稳定性Z>W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
6.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 探究化学反应的限度:取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中即含I2又含I-的实验事实判断该反应是可逆反应 |
13.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
| 序号 | 操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入足量浓NaOH溶液并微热,产生能使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中含NH4+ |
| C | 常温下,测得饱和NaA溶液的pH大于饱和NaB溶液 | 常温下水解程度:A->B- |
| D | 向蔗糖溶液中滴加少量稀H2SO4,水浴加热;向其中滴加少量新制Cu(OH)2悬浊液,加热,无明显现象 | 蔗糖没有水解 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | 浓硫酸被稀释时只有水合过程,所以浓硫酸稀释时放热 | |
| B. | 氯化铵晶体投入水中只有扩散过程,所以氯化铵晶体溶于水吸热 | |
| C. | 烧碱溶于水,溶液温度升高,说明烧碱溶解时水合过程放出的热量大于扩散过程吸收的热量 | |
| D. | 任何物质溶于水,要么温度升高,要么温度下降 |

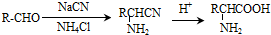
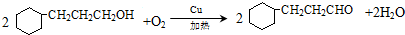 .
.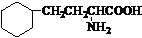 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式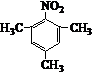 、
、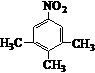 .
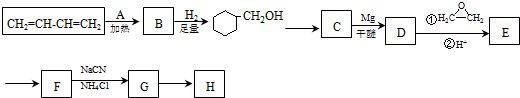
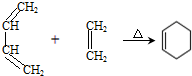
.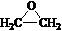 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).