题目内容
4.分析如图所示的四个原电池装置,其中结论正确的是( )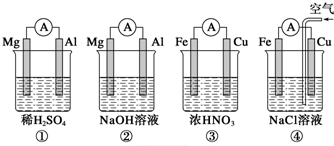
| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,OH-向Al电极移动 | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Na++2e-=2Na |
分析 A、根据氧化还原反应,失电子的极是负极;
B、原电池的正极发生得电子的还原反应;
C、金属铁在常温下遇浓硝酸钝化,金属铜可以和浓硝酸之间反应;
D、铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀.
解答 解:A、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,③中金属铁在常温下遇浓硝酸钝化,不能形成原电池,故A错误;
B、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑,故B正确;
C、金属铁在常温下遇浓硝酸钝化,金属铜可以和浓硝酸之间反应,从而形成原电池,金属铜是负极,Cu-2e-═Cu2+,故C错误;
D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误.
故选:B.
点评 本题考查学生原电池的工作原理知识,可以根据所学内容来回答,难度不大.

练习册系列答案
相关题目
15.丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图1所示:
①10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
(注闪点低于500C属于极易燃烧物质)回答下列问题:
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
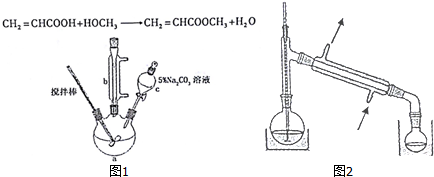
(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①%2油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验.防止明火.
①10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
| 沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
| 丙烯酸 | 142℃ | 与水互溶,易溶于有机溶剂 | 54℃ | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 11℃ | 有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).

(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①%2油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验.防止明火.
12.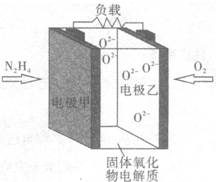 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为N2H4+2O2═2NO+2H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
19.W、X、Y、Z为元素周期表中短周期主族元素,W原子K、M层电子数之和是其核电荷数的一半,X与、W处于同一周期,虽为同周期原子半径最小的金属元素,Y原子K、L层电子数之比为1:2,Y、Z处于同一周期,四种元素最外层电子数之和为18.下列说法正确的是( )
| A. | 原子序数大小顺序为Z>Y>X | B. | W、X的简单离子能抑制水的电离 | ||
| C. | 单质的熔点大小顺序为X>W>Y | D. | 原子半径大小顺序为X>Y>Z |
16.X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子M层有1个电子,Y原子最外层电子数为最内层电子数的2倍,Z元素的最高化合价为最低化合价绝对值的3倍.下列叙述正确的是( )
| A. | 原子半径Z>X>Y | |
| B. | 最高价氧化物的水化物酸性强弱W>Z>Y | |
| C. | 简单气态氢化物的稳定性Z>W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
13.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
| 序号 | 操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入足量浓NaOH溶液并微热,产生能使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中含NH4+ |
| C | 常温下,测得饱和NaA溶液的pH大于饱和NaB溶液 | 常温下水解程度:A->B- |
| D | 向蔗糖溶液中滴加少量稀H2SO4,水浴加热;向其中滴加少量新制Cu(OH)2悬浊液,加热,无明显现象 | 蔗糖没有水解 |
| A. | A | B. | B | C. | C | D. | D |
 今有正反应放热的可逆反应,若反应开始经t1后达平衡,在t2时由于反应条件改变,使平衡破坏,到t3时又达平衡,如图所示.
今有正反应放热的可逆反应,若反应开始经t1后达平衡,在t2时由于反应条件改变,使平衡破坏,到t3时又达平衡,如图所示.