题目内容
18.根据下图,下列判断中正确的是( )
| A. | 石墨与O2生成CO2的反应是吸热反应 | |
| B. | 等量金刚石和石墨完全燃烧,金刚石放出热量更多 | |
| C. | 从能量角度看,金刚石比石墨更稳定 | |
| D. | C(金刚石,s)→C(石墨,s)+Q kJ Q=E3-E2 |
分析 A、根据图象看出石墨与O2的总能量比CO2的高;
B、根据图象看出金刚石、石墨的最终产物均为二氧化碳;
C、根据图象看出金刚石的能量大于石墨的能量;
D、根据图象看出C(金刚石,s)═C(石墨,s)△H=E1-E2.
解答 解:A、根据图象看出石墨与O2的总能量比CO2的高,所以石墨与O2生成CO2的反应是放热反应,故A错误;
B、根据图象看出金刚石、石墨均可生成具有极性共价键的CO2,故B正确;
C、根据图象看出金刚石的能量大于石墨的能量,能量越大越不稳定,故C错误;
D、根据图象看出C(金刚石,s)═C(石墨,s)△H=E1-E2,故D错误.
故选:B.
点评 本题侧重于化学反应原理的探究的考查,题目着重于考查学生的分析能力和自学能力,注意把握题给信息,难度不大.

练习册系列答案
相关题目
8.硝酸与金属反应时,浓度越稀还原产物价态越低.现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示.下列结论正确的是( )
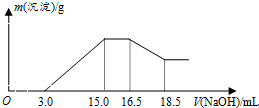

| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
6.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 探究化学反应的限度:取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中即含I2又含I-的实验事实判断该反应是可逆反应 |
13.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
| 序号 | 操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入足量浓NaOH溶液并微热,产生能使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中含NH4+ |
| C | 常温下,测得饱和NaA溶液的pH大于饱和NaB溶液 | 常温下水解程度:A->B- |
| D | 向蔗糖溶液中滴加少量稀H2SO4,水浴加热;向其中滴加少量新制Cu(OH)2悬浊液,加热,无明显现象 | 蔗糖没有水解 |
| A. | A | B. | B | C. | C | D. | D |
3.下列各组金属和液体(配有导线),能组成原电池的是( )
| A. | Cu、Cu、稀硫酸 | B. | C、Pt、氯化钠溶液 | C. | Cu、Zn、酒精 | D. | Fe、Cu、FeCl3溶液 |
4.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| C. | X、Z分别与R形成的化合物中化学键类型相同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |