题目内容
18.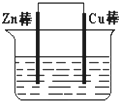 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:(1)若电解质溶液为稀硫酸,则Zn棒为原电池的负极,电极反应式:Zn-2e-=Zn2+.
(2)若电解质为硫酸铜溶液,则Cu棒上发生还原反应(填“氧化”“还原”).
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:1:32.
分析 (1)铜锌原电池中,活泼金属作负极,在正极上有气体生成;
(2)若电解质为硫酸铜溶液,则在正极上析出铜;
(3)根据原电池两极上得失电子数目相等计算.
解答 解:(1)将Zn棒和Cu棒用导线连接后,若电解质溶液为稀硫酸,则锌为负极,负极反应为:Zn-2e-=Zn2+,故答案为:负;Zn-2e-=Zn2+;
(2)将Zn棒和Cu棒用导线连接后,若电解质为硫酸铜溶液,则金属铜是正极,该极上析出铜,反应为:Cu2++2e-=Cu,发生还原反应,故答案为:还原;
(3)设上述两个过程中都消耗1molZn,则:Cu棒上(1)所析出物质的质量为:1mol×2g/mol=2g,(2)所析出物质的质量为:1mol×64g/mol=64g,Cu棒上(1)和(2)所析出物质的质量之比为2g:64g=1:32,故答案为:1:32.
点评 本题考查原电池的工作原理,题目难度不大,注意电极的判断和电解反应式的书写.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
8. A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
 A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )| A. | 4.32 g | B. | 2.16 g | C. | 1.08 g | D. | 0.54 g |
13.分子式为C4H8O2并能与氢氧化钠溶液反应的有机物有(不含立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
3.某化学小组用如图所示装置制取氯气.下列说法正确的是( )
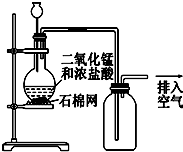

| A. | 该装置图中至少存在三处明显错误 | |
| B. | 该实验中收集氯气的方法不正确 | |
| C. | 如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 | |
| D. | 含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 |
10.A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如图所示.下列分析不正确的是( )


| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
7.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
8.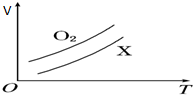 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C2H4 (气) | B. | SO2 | C. | CH4 | D. | NO |
 A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题: ;
;