题目内容
7.下列有关电解质溶液中粒子浓度关系正确的是( )| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
分析 A.根据硫酸氢钠溶液中的电荷守恒和物料守恒分析;
B.氯化银的溶解度大于碘化银,则氯离子浓度大于碘离子;
C.碳酸的电离分步进行,以第一步为主,则碳酸氢根离子浓度大于碳酸根离子;
D.根据物料守恒分析.
解答 解:A.根据电荷守恒,pH=1的NaHSO4溶液存在:c(Na+)+c(H+)=2c(SO42-)+c(OH-),因为c(Na+)=c(SO42-),所以c(H+)=c(SO42-)+c(OH-),故A正确;
B.含有AgCl和AgI固体的悬浊液,碘化银的溶解度小于氯化银,则氯离子浓度大于碘离子,溶液中离子浓度大小为:c(Ag+)>c(Cl-)>c(I-),故B错误;
C.H2CO3的第一步电离大于第二步电离,则c(H+)>c(HCO3-)>c(CO32-)>c(OH-),故C错误;
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)═3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D错误;
故选A.
点评 本题考查了离子浓度大小比较、难溶物溶解平衡应用、弱电解质的电离等知识,题目难度中等,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒的含义,明确难溶物溶解平衡及其应用方法.

练习册系列答案
相关题目
17. 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )| A. | 作用时电子由Zn极经外电路流向Ag2O极,Zn是负极 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极 | |
| C. | 正极的电极反应为Ag2O+2e-+H2O═2Ag+2OH- | |
| D. | Zn极发生氧化反应,Ag2O极发生还原反应 |
15.ClO2是一种安全、高效、强力杀菌剂,其性质如表:
回答下列问题:
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
2.有平衡体系CO(g)+2H2(g)?CH3OH(g)△H<0,为增加甲醇的产量,应采取的正确措施是( )
| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 高温、高压、催化剂 |
12.下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀.
①电离 ②电镀 ③电解 ④电化学腐蚀.
| A. | ①② | B. | ②③ | C. | ③ | D. | 全部 |
19.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6 NA个 | |
| C. | 25℃时,1L0.1mol•L-1FeCl3溶液中含有0.1 NA 个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2 NA |
16.下列说法不正确的是( )
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
17.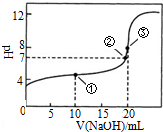 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点③所示溶液中:c(CH3COO-)>c(Na+) |
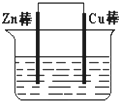 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: