题目内容
6. A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:(1)F元素在周期表中的位置第4周期ⅥA族;F元素价电子排布式3d54s1.
(2)B、C、D、E的原子的第一电离能由小到大的顺序为Mg<C<O<N.(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是CD.
A.分子中都含有σ键和π键
B.都是含极性键和非极性键的直线型分子
C.B2A2的沸点明显低于A2D2
D.都具有还原性
(4)由 A、C 两种元素可以形成一种 CA5的既含离子键又含共价键的化合物,其电子式为
 ;
;(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为1:2.
分析 A的最高正价和最低负价的绝对值相等,原子序数最小是氢;B的基态原子的电子分布在3个不同的能级且各能级中电子数相等是1s22s22p2,是质子数为6的碳,D的基态原子与B的基态原子的未成对电子数目相同,所以D是1s22s22p4,是氧元素,而B、C、D原子序数依次增大,所以C是氮元素,E的基态原子的s能级的电子总数与p能级的电子数相等,所以电子排布为1s22s22p63s2,是镁元素,F的基态原子在同周期元素中未成对电子数最多是第四周期的铬元素,由此分析解答.
解答 解:A的最高正价和最低负价的绝对值相等,原子序数最小是氢;B的基态原子的电子分布在3个不同的能级且各能级中电子数相等是1s22s22p2,是质子数为6的碳,D的基态原子与B的基态原子的未成对电子数目相同,所以D是1s22s22p4,是氧元素,而B、C、D原子序数依次增大,所以C是氮元素,E的基态原子的s能级的电子总数与p能级的电子数相等,所以电子排布为1s22s22p63s2,是镁元素,F的基态原子在同周期元素中未成对电子数最多是第四周期的铬元素,
(1)质子数是24号的铬,在元素周期表中是第4周期ⅥA族;铬元素价电子排布式3d54s1,故答案为:第4周期ⅥA族;3d54s1;
(2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,金属元素第一电离能较小,故C、N、O、Mg四种元素的第一电离能数值由小到大的顺序为Mg<C<O<N,故答案为:Mg<C<O<N;
(3)A.C2H2分子中含有C≡C三键、C-H键,含有σ键和π键,而H2O2分子为H-O-O-H,只含有σ键,故a错误;
B.C2H2、H2O2均含有极性键、非金属性,C2H2是直线型对称结构,是非极性分子,而H2O2分子是展开书页形结构,属于极性分子,故B错误;
C.C2H2常温下为气态,而H2O2常温下为液态,故C正确;
D.C2H2中的碳元素是-1价、H2O2分子中的元素是-1价,都具有还原性,故D正确;
故选答案为:CD;
(4)由 A、C 两种元素可以形成一种 CA5的既含离子键又含共价键的化合物,是NH5氢负离子和铵根离子之间形成离子键,而铵根离子氮与氢之间形成共价键,所以电子式为: ,故答案为:
,故答案为: ;
;
(5)体心立方中Fe原子个数=1+8×$\frac{1}{8}$=2、面心立方中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比=2:4=1:2,
故答案为:1:2.
点评 本题考查物质结构与性质,涉及核外电子排布、电离能、分子结构与性质、配合物、晶胞结构与计算等,学生要熟练掌握基础知识并能迁移运用,难度中等.

 走进文言文系列答案
走进文言文系列答案 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )| A. | 作用时电子由Zn极经外电路流向Ag2O极,Zn是负极 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极 | |
| C. | 正极的电极反应为Ag2O+2e-+H2O═2Ag+2OH- | |
| D. | Zn极发生氧化反应,Ag2O极发生还原反应 |
| A. | 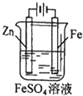 铁片镀锌 | B. | 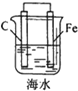 模拟吸氧腐蚀 | C. | 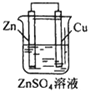 铜锌原电池 | D. | 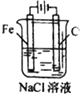 电解法制氯气 |
| A. | 40% | B. | 33% | C. | 60% | D. | 36% |
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
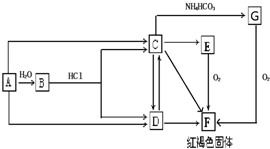
 甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
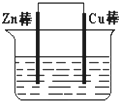 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: