题目内容
19.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.现给出化学键的键能(见表):| 化学键 | H-H | Br-Br | H-Br |
| 键能/(kJ•mol-1) | 436 | 193 | 366 |
| A. | +103 kJ•mol-1 | B. | +679 kJ•mol-1 | C. | -103 kJ•mol-1 | D. | +183 kJ•mol-1 |
分析 焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:由表格数据及H2(g)+Br2(g)═2HBr(g)可知,H2(g)+Br2(g)═2HBr(g)的△H=436kJ/mol+193kJ/mol-2×366kJ/mol=-103 kJ•mol-1,
故选C.
点评 本题考查反应热与焓变,为高频考点,把握键能与焓变的关系为解答的关键,侧重分析与应用能力的考查,注意物质中化学键数目,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
10.CsICl2是一种碱金属的化合物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是( )
| A. | Cs显+3价,I、Cl均显-1价 | |
| B. | 在CsICl2溶液中通入SO2气体,有硫酸生成 | |
| C. | Cs显+1价,Cl显+1价,I显-3价 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
14.光纤通讯是一种现代化的通讯手段,光纤通讯容量大,一对光纤上可同时传送3万门电 话的信号.制造光导纤维的主要原料是SiO2.下列关于SiO2的说法正确的是( )
| A. | SiO2摩尔质量是60 | |
| B. | 1 molSiO2中含有1 molO2 | |
| C. | 1.5 molSiO2中含有1.806×1024个氧原子 | |
| D. | 1 molSiO2质量是60 g•mol-1 |
11.碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol.
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式C2H2-10e-+14OH-=2CO32-+8H2O.
(3)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①10min~20min以v(NO)表示的反应速率为0.012mol/(L•min).
②下列各项能判断该反应达到平衡状态的是ACE(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
E.混合气体的密度保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变 (填“增大”、“不变”或“减小”).
(4)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图1中画出c(CO)随反应时间t变化的曲线.
(5)已知:CO(g)+H2O(g)H2(g)+CO2(g)?H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是B(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应正向移动
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(6)图3表示在温度分别为T1、T2时,平衡体系中CO的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),由状态B到状态A,可采用升温的方法(填“升温”或“降温”).

(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol.
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式C2H2-10e-+14OH-=2CO32-+8H2O.
(3)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②下列各项能判断该反应达到平衡状态的是ACE(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
E.混合气体的密度保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变 (填“增大”、“不变”或“减小”).
(4)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图1中画出c(CO)随反应时间t变化的曲线.
(5)已知:CO(g)+H2O(g)H2(g)+CO2(g)?H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是B(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应正向移动
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(6)图3表示在温度分别为T1、T2时,平衡体系中CO的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),由状态B到状态A,可采用升温的方法(填“升温”或“降温”).

6.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 10 L pH=1的硫酸溶液中含有的H+为2NA | |
| D. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
 A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.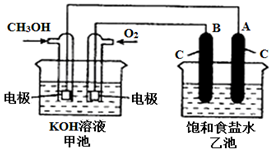 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.