题目内容
7.含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染.其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH-(1)上述反应中,生成标准状况下11.2L氮气时,转移的电子为5mol.现在要除去1m3含氮元素0.4mol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝18g;
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同.
①写出镁和含氮废水反应的离子方程式2NO3-+5Mg+6H2O═N2↑+5Mg(OH)2+2OH-;
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+CI2↑,若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水14.25kg.
分析 (1)氧化还原反应中,化合价升高元素失去电子,化合价降低元素对应的产物是还原产物,根据化学方程式来计算反应转移电子的量;根据化学方程式中硝酸根离子和金属铝之间的关系来计算回答;
(2)①金属镁比铝能更快消除氮的污染,反应原理和金属铝相同,所以产物为氮气、氢氧化镁、氢氧根离子.根据电子转移守恒结合元素守恒、电荷守恒配平;
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+CI2↑;根据关系式5MgCl2~5Mg~2NO3-计算.
解答 解:(1)氧化还原反应中,化合价升高元素Al失去电子,化合价降低的N元素对应的产物N2是还原产物,根据化学方程式可知,生成3mol的氮气转移电子是30mol,生成标准状况下11.2L氮气的物质的量为0.5mol时,转移电子是5mol,因为含氮0.4mol的废水中的NO3-的物质的量为0.4mol,由化学方程式可知,0.4mol的硝酸根离子消耗金属铝的物质的量为$\frac{10}{6}×0.4$mol,所以铝的质量为:$\frac{10}{6}×0.4$mol×27g/mol=18g,故答案为:5;18;
(2)①金属镁比铝能更快消除氮的污染,反应原理和金属铝相同,所以产物为氮气、氢氧化镁、氢氧根离子,
反应离子方程式为2NO3-+5Mg+6H2O═N2↑+5Mg(OH)2+2OH-,
故答案为:2NO3-+5Mg+6H2O═N2↑+5Mg(OH)2+2OH-;
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+CI2↑;令至少需要含0.5%(质量分数)MgCl2的海水mkg,则:
5MgCl2~~~~5Mg~~~~2NO3-
5×95g 2mol
m×103g×0.5% 0.3mol
所以$\frac{5×95g}{m×1{0}^{3}g×0.5%}$=$\frac{2mol}{0.3mol}$,解得m=14.25,故答案为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+CI2↑;14.25.
点评 本题考查氧化还原反应的计算、离子方程式等,难度中等,本题计算利用方程式及关系式进行,比电子转移守恒计算直观,根据情况选择.

 名校课堂系列答案
名校课堂系列答案| A. | 物质的量是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA 个H2O 分子的质量总和 | |
| D. | 硫酸的摩尔质量是98g |
| A. | 酚酞试液 | B. | 紫色石蕊试液 | C. | AgNO3 溶液 | D. | NaHCO3溶液 |
| A. | Na、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | NH4+、K+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
| 化学键 | H-H | Br-Br | H-Br |
| 键能/(kJ•mol-1) | 436 | 193 | 366 |
| A. | +103 kJ•mol-1 | B. | +679 kJ•mol-1 | C. | -103 kJ•mol-1 | D. | +183 kJ•mol-1 |
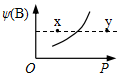 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
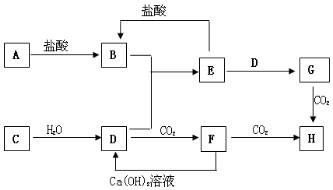 如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)
如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去) ;F是Na2CO3.(填化学式)
;F是Na2CO3.(填化学式)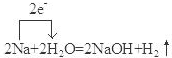 .
.