题目内容
10.下列有关钠及其化合物的说法不正确的是( )| A. | 电解饱和食盐水不可制取金属钠 | |
| B. | 钠与氧气反应的产物与反应条件有关 | |
| C. | 过氧化钠与水反应不能生成氢氧化钠 | |
| D. | 钠可以从四氯化钛中置换出钛 |
分析 A、电解饱和食盐水制氢氧化钠、氢气和氯气;
B、钠在没有条件下和氧气反应生成氧化钠,在点燃条件下,和氧气反应生成淡黄色的过氧化钠;
C、过氧化钠与水反应生成氢氧化钠和氧气;
D、Na是活泼金属,具有强还原性.
解答 解:A、电解饱和食盐水可以得到烧碱、氢气和氯气,电解熔融的氯化钠可以获得金属钠,故A正确;
B、钠在没有条件下和氧气反应生成氧化钠,在点燃条件下,和氧气反应生成淡黄色的过氧化钠,故B正确;
C、过氧化钠与水反应生成氢氧化钠和氧气,故C错误;
D、Na是活泼金属,具有强还原性,所以用钠从四氯化钛中置换钛,利用了钠的强还原性,故D正确.
故选C.
点评 本题涉及金属的冶炼知识,不同金属的活泼性不同,冶炼方法也不一样,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
18.“绿色化学”特点之一是:提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”.以下反应不符合绿色化学原子经济性要求的是( )
| A. | 乙烯在银作催化剂的条件下与氧气反应生成环氧乙烷 | |
| B. | 乙烯水化法制乙醇 | |
| C. | 乙烯与氯化氢加成制氯乙烷 | |
| D. | 利用乙烯与氢气加成制得的乙烷与氯气在光照条件下制氯乙烷 |
5.物质溶于水的过程中通常伴随着能量的变化,表为四种物质的溶解热(“+”为放热,“-”为吸热):
将等质量的上述物质加入等质量的水中,对水的电离平衡影响最小的是( )
| 化学式 | NH4NO3 | NaOH | NaCl | KNO3 |
| 溶解热(kJ/kg) | -330.75 | +1040.5 | -84.10 | -353.17 |
| A. | NH4NO3 | B. | NaOH | C. | NaCl | D. | KNO3 |
2.下列反应的离子方程式正确的是( )
| A. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
19.根据如图提供的信息,下列所得结论正确的是( )
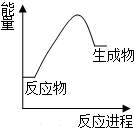

| A. | 生成物比反应物稳定 | |
| B. | 该反应的△H<0 | |
| C. | 该图可以表示石灰石高温分解反应 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定不能发生 |
11.某实验小组进行了“影响化学反应速率”的探究实验,原始数据记录如下:
(1)比较三组数据,初步得出的结论是:当其他条件不变时,H2SO4(填化学式)的浓度增加,反应速率加快(填“加快”、“减慢”或“不变”); 对比①、②两组实验,你认为影响反应速率的因素是固体接触面积.
(2)写出该反应的离子方程式Zn+2H+═Zn2++H2↑,
(3)经过试验对比,同学们在①组试验的试管中,滴入几滴CuSO4溶液后,锌粒表面有紫红色物质生成,同时发现试管中产生气泡的速度明显加快,请你分析,产生这种现象加快反应速率的原因是因为发生了原电池反应.
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
(2)写出该反应的离子方程式Zn+2H+═Zn2++H2↑,
(3)经过试验对比,同学们在①组试验的试管中,滴入几滴CuSO4溶液后,锌粒表面有紫红色物质生成,同时发现试管中产生气泡的速度明显加快,请你分析,产生这种现象加快反应速率的原因是因为发生了原电池反应.
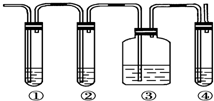 实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.试回答下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.试回答下列问题: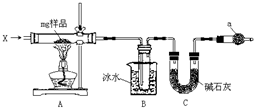 为确定碳酸钠和碳酸氢钠混合样品中碳酸氢钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如图:
为确定碳酸钠和碳酸氢钠混合样品中碳酸氢钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如图: