题目内容
5.物质溶于水的过程中通常伴随着能量的变化,表为四种物质的溶解热(“+”为放热,“-”为吸热):| 化学式 | NH4NO3 | NaOH | NaCl | KNO3 |
| 溶解热(kJ/kg) | -330.75 | +1040.5 | -84.10 | -353.17 |
| A. | NH4NO3 | B. | NaOH | C. | NaCl | D. | KNO3 |
分析 根据表中数据可知,四种物质中NaCl、KNO3对水的电离平衡没有影响,且等质量条件下溶解时的热效应NaCl较小,因此对水的电离的影响程度最小;硝酸钡、氢氧化钠的热效应大于硝酸钾和氯化钠,且氢氧化钠电离的氢氧根离子抑制了水的电离;而硝酸铵中的铵离子水解,促进了水的电离,对水的电离影响较大,据此进行解答.
解答 解:根据四种物质的溶解热可知,等质量时,四种物质的热效应最小的为NH4NO3,其次为KNO3,最小的是NaCl,最大的是NaOH;水的电离为吸热反应,温度影响水的电离,所以热效应越小,温度对水的电离影响越小,又由于硝酸铵中的铵离子水解,促进了水的电离,而硝酸钾和氯化钠不水解,所以综合考虑,对水的电离程度影响最小的为NaCl,
故选C.
点评 本题考查水的电离平衡,考查考生对水的电离平衡的理解能力,难度中等,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
15.一定条件下,在体积为5L的密闭容器中,2mol X和1mol Y进行反应:X(g)+Y(g)?Z(g)△H,反应经60s达到平衡并生成0.5mol Z,则下列说法中不正确的是( )
| A. | 其他条件不变,若起始时加入1molx和2molY,则平衡时Z的物质的量仍为0.5mol | |
| B. | 其他条件不变,再向容器中加入2 mol X和1 mol Y,平衡正向移动,平衡时X、Y的转化率增大 | |
| C. | 其他条件不变,升高一定温度后,该反应平衡常数K=2.0,则△H>0 | |
| D. | 以x浓度变化表示的反应速率为0.01 mol/(L•min) |
16.漂白粉的有效成分是( )
| A. | Ca(ClO)2 | B. | CaCl2 | C. | Ca(OH)2 | D. | CaCO3 |
20.下列各有机物中,属于烃的是( )
| A. | 乙酸 | B. | 甲烷 | C. | 苯酚 | D. | 乙醇 |
10.下列有关钠及其化合物的说法不正确的是( )
| A. | 电解饱和食盐水不可制取金属钠 | |
| B. | 钠与氧气反应的产物与反应条件有关 | |
| C. | 过氧化钠与水反应不能生成氢氧化钠 | |
| D. | 钠可以从四氯化钛中置换出钛 |
17.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 垃圾是放错地方的资源,应分类回收利用 | |
| B. | 实现化石燃料清洁利用,就无需开发新能源 | |
| C. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| D. | 将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油 |
14.下列有关化学用语正确的是( )
| A. | N2的电子式: | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$I | |
| C. | S2-的结构示意图: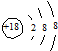 | |
| D. | 乙烯的结构简式:CH2═CH2 |
6.小明体检的血液化验单中,葡萄糖为5.9mmol/L.该体检指标的物理量是( )
| A. | 物质的量浓度 | B. | 溶解度 | C. | 质量分数 | D. | 摩尔质量 |