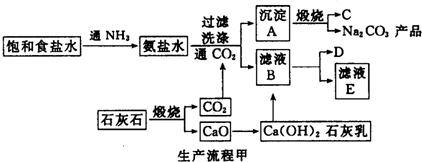
题目内容
1.探究浓度对反应速率的影响的实验中KMnO4酸性溶液与H2C2O4(草酸)溶液反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;实验过程中加入相同体积不同浓度的H2C2O4(填“H2C2O4”或“KMnO4”)溶液,记录溶液褪色所需的时间从而证明反应物浓度越大,反应速率越快.分析 KMnO4酸性溶液与H2C2O4(草酸)溶液在酸性环境下会发生氧化还原反应,反应过程中高锰酸钾被还原,会褪色,根据溶液褪色所需的时间可以判断反应速率的大小.
解答 解:KMnO4酸性溶液与H2C2O4(草酸)溶液在酸性环境下会发生氧化还原反应:KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,反应过程中高锰酸钾被还原,会褪色根据溶液褪色所需的时间可以判断反应速率的大小,
故答案为:KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;溶液褪色所需的时间.
点评 本题考查了探究浓度对反应速率的影响,题目难度中等,注意掌握温度、浓度、压强等对反应速率的影响,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
12.下列化学药品与其危险化学品图形标志不一致的是( )
| A. |  活性炭 | B. |  天然气 | C. |  酒精 | D. |  白磷 |
16.某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则( )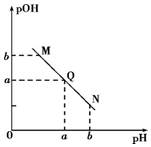

| A. | N点处pH>pOH,则N点处所示溶液呈酸性 | |
| B. | 该温度下水的离子积Kw=1×10-2a | |
| C. | Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等 | |
| D. | M点所示溶液的导电能力强于Q |
6.容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,其上标有①温度、②浓度、③容量、④压强、⑤刻度线.这五项中的( )
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
4.根据下列实验操作和现象所得结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
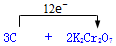 .
.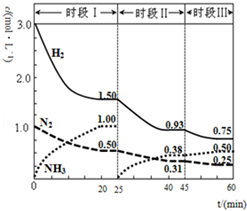 N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.
N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.