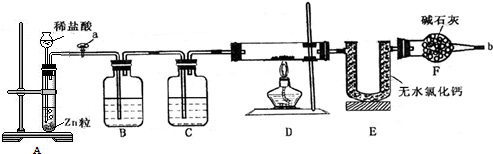
题目内容
5.某一周期的稀有气体原子最外层电子构型为4s24p6,该周期有四种元素A、B、C、D,已知它们最外层电子数分别为2、2、1、7,A和C的次外层电子数均为8,B和D的次外层电子数均为18.则A元素符号为Ca,B原子外围电子排布式为3d104s2,C价电子排布式为4s1,D元素形成的简单离子的电子排布式为1s22s22p63s23p63d104s24p6.分析 在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,B、D两元素原子的次外层电子数为18,则B为Zn、D为Br,以此解答该题.
解答 解:在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,价电子排布式为4s1,B、D两元素原子的次外层电子数为18,则B为Zn、外围电子排布式为:3d104s2,D为Br,形成的简单离子的电子排布式为1s22s22p63s23p63d104s24p6,
故答案为:Ca;3d104s2;4s1;1s22s22p63s23p63d104s24p6.
点评 本题考查位置结构性质关系应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目涉及核外电子排布等知识点,注意掌握核外电子排布规律,难度不大.

练习册系列答案
相关题目
15.下列有关叙述正确的是( )
| A. | 若某化学反应的反应物总能量高于生成物总能量,则该反应为吸热反应 | |
| B. | 反应2SO2+O2$?_{加热}^{催化剂}$2SO3达平衡后,若升高温度,v(逆)增大,v(正)减小 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△S>0 | |
| D. | 化学上通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达到完全 |
16.下列依据相关实验得出的结论正确的是( )
| A. | 用铂丝蘸取少量某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 | |
| B. | 在0.1mol•L-1Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应 | |
| C. | 向某FeCl2 溶液中加入KSCN溶液,观察到溶液呈血红色,说明该溶液中FeCl2已全部被氧化 | |
| D. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32- |
13.把200mL 有BaCl2和KCl 的混合溶液分成2 等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 5(b-2a) mol/L | B. | 10(2a-b) mol/L | C. | 10(b-a) mol/L | D. | 10(b-2a) mol/L |
10.在室温度下,在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到室温度,压强减小至原来的一半,若加入NaOH溶液则气体被全部吸收,则此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C6H6 |
14.同温同压下,两种气体的体积如果不相同,其主要原因是( )
| A. | 气体的分子大小不同 | B. | 气体的物质的量不同 | ||
| C. | 气体的性质不同 | D. | 气体的分子间距离不同 |
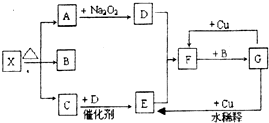 图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.