题目内容
13.把200mL 有BaCl2和KCl 的混合溶液分成2 等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )| A. | 5(b-2a) mol/L | B. | 10(2a-b) mol/L | C. | 10(b-a) mol/L | D. | 10(b-2a) mol/L |
分析 混合溶液分成两等份,每份溶液浓度相同.一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4);
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),
再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度相同.一份加入含a mol 硫酸钠的溶液,发生反应为Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,则每份溶液中n(Ba2+)=(Na2SO4)=amol;
另一份加入含bmol 硝酸银的溶液,发生反应为Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=bmol,
根据电荷守恒可知每份中满足:2n(Ba2+)+n(K+)=n(Cl-),则每份溶液中n(K+)=bmol-2amol=(b-2a)mol,
所以溶液中钾离子浓度为:c(K+)=$\frac{(b-2a)mol}{0.1L}$=10(b-2a) mol•L-1,
故选D.
点评 本题考查离子反应的有关计算、物质的量浓度的计算,题目难度中等,根据电荷守恒计算钾离子的物质的量是关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.下列比较中正确的是( )
| A. | 碱性:KOH>Mg(OH)2>NaOH | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 原子半径:K>Na>Mg | D. | 氢化物稳定性:NH3>H2O>HF |
4.下列说法正确的是( )
| A. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| B. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
18.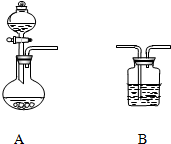 某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:
某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:
试剂:①NaHCO3溶液②稀H2SO4③浓HCl 溶液④酸性高锰酸钾⑤澄清的石灰水⑥品红试液
(1)提出合理假设假设1:该白色粉末成分为碳酸钠;
假设2:白色粉末成分为亚硫酸钠;
假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物.
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成.装置A 中选用的溶液是②(填序号,下同).若气体的流向从左向右,装置B(重复使用)中所盛的试剂依次为⑥④⑥⑤.
(3)根据(2)的连接顺序进行实验,填写相应现象.
 某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:
某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:试剂:①NaHCO3溶液②稀H2SO4③浓HCl 溶液④酸性高锰酸钾⑤澄清的石灰水⑥品红试液
(1)提出合理假设假设1:该白色粉末成分为碳酸钠;
假设2:白色粉末成分为亚硫酸钠;
假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物.
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成.装置A 中选用的溶液是②(填序号,下同).若气体的流向从左向右,装置B(重复使用)中所盛的试剂依次为⑥④⑥⑤.
(3)根据(2)的连接顺序进行实验,填写相应现象.
| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
2.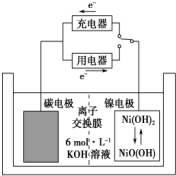 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )| A. | 充电时阴极反应:2H2O+2e-═2OH-+H2↑ | |
| B. | 充电时将碳电极与电源的负极相连 | |
| C. | 放电时,OH-移向碳电极 | |
| D. | 放电时镍电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
3.下列所述反应的方程式或关系式正确的是( )
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 向硫酸铵溶液中加入适量氨水,当溶液呈酸性时,溶液中c(SO42-)=c(NH4+) | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-=Mg(OH)2↓,3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| D. | 浓度相等的①NH4HSO4②NH4C1③(NH4)2SO4溶液中,c(NH4+)的大小顺序为③>①>② |