题目内容
20.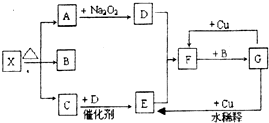 图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.(1)写出下列各物质的化学式:
X:(NH4)2CO3;F:NO2;G:HNO3.
(2)写出下列变化的离子方程式:
F→G:3 NO2+H2O=2H++2NO3-+NO;
G→E:3Cu+8 H++2 NO3-=3Cu2++2NO↑+4H2O.
(3)实验室里,C常采用向下排空气法法来收集.
(4)另有两种盐Y、Z,元素种类以及阳离子与X相同.其中,Y受热分解的产物与X完全相同,但混合气体的平均相对分子质量为26.33; Z受热分解产物中不仅有A、B、C,还含有另一种可燃性气体H,且四种气体的物质的量之比为1:1:1:1,则Y、Z的化学式分别是NH4HCO3、NH4HC2O4.
分析 C能使湿润的红色石蕊试纸变蓝,应为NH3,A和过氧化钠反应生成D为气体,且A是无色气体,所以A应为CO2,D为O2,氨气和氧气在催化剂条件下加热生成NO和水,E能和氧气反应,所以E是NO,F是F为NO2,F和B反应生成G,G和铜反应生成二氧化氮,则B应为H2O,G为HNO3,X可能为NH4HCO3或(NH4)2CO3,X分解所得A、B、C混合气体的平均相对分子质量为24,则X为 (NH4)2CO3,X分解所得CO2、H2O、NH3混合气体的平均相对分子质量为24,假设X是(NH4)2CO3,发生反应为(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+H2O+2NH3↑,其平均相对分子质量=$\frac{96}{4}$=24,所以X为(NH4)2CO3,再结合题目分析解答.结合相关物质的性质解答该题.
解答 解:C能使湿润的红色石蕊试纸变蓝,应为NH3,A和过氧化钠反应生成D为气体,且A是无色气体,所以A应为CO2,D为O2,氨气和氧气在催化剂条件下加热生成NO和水,E能和氧气反应,所以E是NO,F是F为NO2,F和B反应生成G,G和铜反应生成二氧化氮,则B应为H2O,G为HNO3,X可能为NH4HCO3或(NH4)2CO3,X分解所得A、B、C混合气体的平均相对分子质量为24,则X为 (NH4)2CO3,X分解所得CO2、H2O、NH3混合气体的平均相对分子质量为24,假设X是(NH4)2CO3,发生反应为(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+H2O+2NH3↑,其平均相对分子质量=$\frac{96}{4}$=24,所以X为(NH4)2CO3,再结合题目分析解答,
(1)通过以上分析知,X、F、G分别是:(NH4)2CO3、NO2、HNO3,
故答案为:(NH4)2CO3;NO2;HNO3;
(2)二氧化氮和水反应生成硝酸和一氧化氮,离子反应方程式为:3 NO2+H2O=2H++2NO3-+NO,
铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8 H++2 NO3-=3Cu2++2NO↑+4H2O,
故答案为:3 NO2+H2O=2H++2NO3-+NO;3Cu+8 H++2 NO3-=3Cu2++2NO↑+4H2O;
(3)C是氨气,氨气极易溶于水且密度小于空气,所以可以采用向下排空气法收集,故答案为:向下排空气法.
(4)另有两种盐Y、Z,元素种类以及阳离子与X相同.其中,Y受热分解的产物与X完全相同,但混合气体的平均相对分子质量为26.33,该物质是NH4HCO3;
Z受热分解产物中不仅有A、B、C,还含有另一种可燃性气体H,根据元素守恒知,该可燃性气体为CO,且四种气体的物质的量之比为1:1:1:1,则该分子的化学式为NH4HC2O4,故答案为:NH4HCO3;NH4HC2O4.
点评 本题考查了无机物推断,根据气体的颜色、物质的性质、物质之间的转化等来推断物质,会利用平均相对分子质量法确定X、Y物质,题目难度中等.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 | |
| C. | 若在含I-的滤液中加入几滴淀粉溶液,溶液变蓝色 | |
| D. | 碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取” |
| A. | 通入大量NO,ν正、ν逆均增大 | |
| B. | 恒温恒容下充入Ne,ν正、ν逆均不变 | |
| C. | ν正(NO)=2ν逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |
| 步骤 | 操作 | 现象 |
| (1) | 向溶液中滴加稀盐酸 | 有刺激性气味气体产生 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得的水溶液中加入Ba(NO3)2和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | 若2molNa2O2完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是1:1 | |
| D. | Na2O2中阳离子与阴离子的个数比为1:1 |
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(2)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图1:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
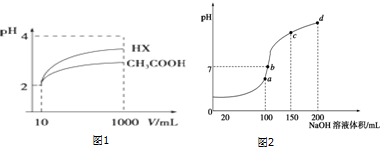
(3)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④⑤ (填写序号).
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A 中有锌剩余 ⑥B中有锌剩余
(4)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液
中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).

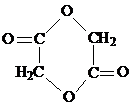 .
.


 (任写其中一种).
(任写其中一种).