题目内容
10.在室温度下,在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到室温度,压强减小至原来的一半,若加入NaOH溶液则气体被全部吸收,则此烃为( )| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C6H6 |
分析 反应后加NaOH的溶液则气体全部被吸收,说明气态烃与氧气混合后恰好完全反应生成生成二氧化碳和水,压强减小至原来的一半,压强之比等于物质的量之比,容器内反应后气体的物质的量为是反应前的一半,恢复到室温,水为液体,结合方程式计算.
解答 解:设此烃的化学式为CxHy,则有
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O
1 x+$\frac{y}{4}$ x
体积减小至原来的一半,可知1+x+$\frac{y}{4}$=2x,
整理可得:4x=4+y,
若x=1,则y=0,不存在此物质,
若x=2,则y=4,物质为C2H4,
若x=3,则y=8,物质为C3H8,
故选B.
点评 本题考查了利用方程式进行的讨论计算,难度不大,关键判断烃与氧气混合后恰好完全反应生成生成二氧化碳和水,再依据化学方程式中气体前面的化学计量数进行计算.

练习册系列答案
相关题目
20.下列有关各微粒的浓度关系不正确的是( )
| A. | 0.2 mol•L-1 NH4Cl和0.1 mol•L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 向醋酸钠溶液中加入醋酸至溶液呈酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(H+)+c (Cl-) |
18. 某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:
某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:
试剂:①NaHCO3溶液②稀H2SO4③浓HCl 溶液④酸性高锰酸钾⑤澄清的石灰水⑥品红试液
(1)提出合理假设假设1:该白色粉末成分为碳酸钠;
假设2:白色粉末成分为亚硫酸钠;
假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物.
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成.装置A 中选用的溶液是②(填序号,下同).若气体的流向从左向右,装置B(重复使用)中所盛的试剂依次为⑥④⑥⑤.
(3)根据(2)的连接顺序进行实验,填写相应现象.
 某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:
某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:试剂:①NaHCO3溶液②稀H2SO4③浓HCl 溶液④酸性高锰酸钾⑤澄清的石灰水⑥品红试液
(1)提出合理假设假设1:该白色粉末成分为碳酸钠;
假设2:白色粉末成分为亚硫酸钠;
假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物.
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成.装置A 中选用的溶液是②(填序号,下同).若气体的流向从左向右,装置B(重复使用)中所盛的试剂依次为⑥④⑥⑤.
(3)根据(2)的连接顺序进行实验,填写相应现象.
| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
2.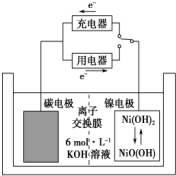 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )| A. | 充电时阴极反应:2H2O+2e-═2OH-+H2↑ | |
| B. | 充电时将碳电极与电源的负极相连 | |
| C. | 放电时,OH-移向碳电极 | |
| D. | 放电时镍电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |

 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.