题目内容
 请回答下列问题
请回答下列问题(1)已知:25℃时,0.1mol?L-1的HA溶液中c(H+)/c(OH-)=1010.
①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是
A.c(H+)/c(HA) B.c(HA)/c (A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1mL与pH=12的NaOH溶液V2mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+)+c(OH-)=2.0×10-7 mol?L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp=1.8×10-10,现将足量AgCl分别放入:①100mL 蒸馏水中;②100mL 0.2mol?L-1 AgNO3溶液中;③100mL 0.1mol?L-1 AlCl3溶液中;④100mL 0.1mol?L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
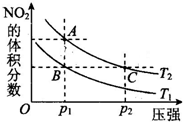
(3)对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是
①A、C两点的反应速率:A>C
②A、C两点气体的颜色:A深、C浅
③B、C两点的气体的平均分子质量:B<C
④由状态B到状态A,可以用加热方法.
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)①25℃时,0.1mol?L-1的某酸HA中,如果该酸是强酸,则
=1012,实际上中
=1010所以该酸是弱酸;
②加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢氧根离子浓度增大,注意水的离子积常数只与温度有关,与溶液的酸碱性无关;
③A.若混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度;
B.如果二者体积相等,根据酸的强弱判断混合溶液的酸碱性;
C.如果溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液;
(2)氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化;依据溶度积分别计算;
(3)N2O4(g)═2NO2(g)△H<0,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答,
①C两点都在等温线上,压强越大,反应速率越快;
②压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,A点NO2的体积分数大;
③由图象可知,B、C两点NO2的体积分数相同,则气体的物质的量相同,据此判断;
④根据温度和压强对反应速率的影响来回答.
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
②加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢氧根离子浓度增大,注意水的离子积常数只与温度有关,与溶液的酸碱性无关;
③A.若混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度;
B.如果二者体积相等,根据酸的强弱判断混合溶液的酸碱性;
C.如果溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液;
(2)氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化;依据溶度积分别计算;
(3)N2O4(g)═2NO2(g)△H<0,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答,
①C两点都在等温线上,压强越大,反应速率越快;
②压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,A点NO2的体积分数大;
③由图象可知,B、C两点NO2的体积分数相同,则气体的物质的量相同,据此判断;
④根据温度和压强对反应速率的影响来回答.
解答:
解:(1)①25℃时,0.1mol?L-1的某酸HA中,如果该酸是强酸,则解:(1)①25℃时,0.1mol?L-1的某酸HA中,如果该酸是强酸,则
=1012>
=1010,所以该酸是弱酸,即弱电解质,
故答案为:弱电解质;
②A.加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢离子浓度减小的量小于酸分子减小的量,所以
增大,故A错误;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则
减小,故B正确;
C.温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
故答案为:B;
③A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,故A正确;
B.若V1=V2,则酸的浓度大,酸过量,则溶液M的pH一定小于7,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故D正确;
故答案为:AD;
(2)氯化银饱和溶液中存在沉淀溶解平衡,氯离子浓度越大,则银离子浓度越小,
①100mL蒸馏水中氯化银形成饱和溶液,Ag+浓度为
×10-5mol/l;
②100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,
③100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;
④100mL 0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;
综上所述大小顺序为:②>①>④>③,
故答案为:②>①>④>③;
(3)①由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故①错误;
②A、C两点温度相同,但压强不同,NO2为红棕色气体,由图象可知,A点NO2的体积分数大,则A、C两点气体的颜色:A深,C浅,故②错误;
③由图象可知,B、C两点NO2的体积分数相同,则气体的物质的量相同,所以平均相对分子质量相同,故③错误;
④升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故④正确;
故答案为:④.
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
故答案为:弱电解质;
②A.加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢离子浓度减小的量小于酸分子减小的量,所以
| c(H+) |
| c(HA) |
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则
| c(HA) |
| c(A-) |
C.温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
故答案为:B;
③A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,故A正确;
B.若V1=V2,则酸的浓度大,酸过量,则溶液M的pH一定小于7,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故D正确;
故答案为:AD;
(2)氯化银饱和溶液中存在沉淀溶解平衡,氯离子浓度越大,则银离子浓度越小,
①100mL蒸馏水中氯化银形成饱和溶液,Ag+浓度为
| 1.8 |
②100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,
③100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;
④100mL 0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;
综上所述大小顺序为:②>①>④>③,
故答案为:②>①>④>③;
(3)①由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故①错误;
②A、C两点温度相同,但压强不同,NO2为红棕色气体,由图象可知,A点NO2的体积分数大,则A、C两点气体的颜色:A深,C浅,故②错误;
③由图象可知,B、C两点NO2的体积分数相同,则气体的物质的量相同,所以平均相对分子质量相同,故③错误;
④升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故④正确;
故答案为:④.
点评:本题考查较为综合,涉及弱电解质的电离、化学平衡的影响因素、酸碱混合溶液的计算、电化学以及盖斯定律的应用等,题目难度中等,注意体会盖斯定律的应用,把握燃料电池中电极方程式的书写.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列说法正确的是( )
| A、乙烷、乙醇都能与钠反应生成氢气 |
| B、用过滤的方法可以分离乙酸乙酯和乙酸 |
| C、75%(体积分数)的乙醇溶液常用于医疗消毒 |
| D、在一定条件下,乙烯可以与氢气发生加成反应,苯则不能 |
将pH=13的强碱溶液与pH=2的强酸溶液混合后,pH=11,则强碱与强酸的体积比为( )
| A、11:1 | B、9:1 |
| C、1:1 | D、1:9 |
强弱电解质的本质区别是( )
| A、导电能力 | B、化学键的类型 |
| C、溶解度 | D、电离程度 |
将容积为50mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL.则原混合气体中NO2和O2体积比可能是( )
| A、9:1 | B、18:7 |
| C、41:9 | D、1:1 |
向体积为VL的NaALO2溶液中,开始通入amolHCl气体,则有bmol沉淀析出,继续通入cmolHCl气体后,产生的沉淀又恰好溶解,则原NaAlO2溶液的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|