题目内容
将pH=13的强碱溶液与pH=2的强酸溶液混合后,pH=11,则强碱与强酸的体积比为( )
| A、11:1 | B、9:1 |
| C、1:1 | D、1:9 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:常温下pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合溶液的pH=11,则混合溶液中c(OH-)=0.001mol/L,根据混合溶液中c(OH-)=
计算.
| c(碱)V(碱)-c(酸)V(酸) |
| V(酸)+V(碱) |
解答:
解:设酸的体积为xL、碱的体积为yL、pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合溶液的pH=11,则混合溶液中c(OH-)=0.001mol/L,
根据混合溶液中氢氧根离子浓度为:c(OH-)=
=
=0.001mol/L,
解得:y:x=1:9,
故选D.
根据混合溶液中氢氧根离子浓度为:c(OH-)=
| c(碱)V(碱)-c(酸)V(酸) |
| V(酸)+V(碱) |
| 0.1mol/L×yL-0.01mol/L×xL |
| x+y |
解得:y:x=1:9,
故选D.
点评:本题考查了pH的简单计算,题目难度中等,明确溶液的酸碱性,结合公式c(OH-)=
进行分析解答即可,试题培养了学生灵活应用所学知识的能力.
| c(碱)V(碱)-c(酸)V(酸) |
| V(酸)+V(碱) |

练习册系列答案
相关题目
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A、MgO和Al2O3都可以做耐高温材料 |
| B、Si可用作太阳能电池材料 |
| C、工业上采用电解水法制氢气,解决能源短缺 |
| D、氢氧化铝用于治疗胃酸过多 |
下列物质中,既能和酸反应又能和碱反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
| A、②③④ | B、①②④ |
| C、①②③④ | D、①③④ |
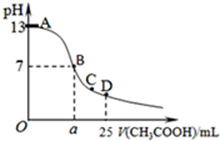 某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是( )
| A、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
已知某温度下,Ksp(AgCl)=1.56×10-10 mol2?L-2,Ksp(Ag2CrO4)=1.12×10-12 mol3?L-3,下列叙述正确的是( )
| A、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| B、向2.0×10-4mol?L-1的K2CrO4溶液中加入等体积的2.0×10-4 mol?L-1 AgNO3溶液,则有Ag2CrO4沉淀生成 |
| C、将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 |
| D、将0.001 mol?L-1的AgNO3溶液逐滴滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4的混合溶液中,则先产生AgCl沉淀 |
相同条件下,等体积、等pH的醋酸溶液和盐酸溶液加水稀释相同的倍数后,所得溶液的pH( )
| A、仍相同 | B、醋酸溶液的大 |
| C、盐酸的大 | D、无法判断 |
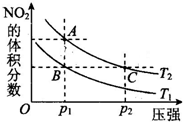
在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如下表:下列说法正确的是( )
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如下表:下列说法正确的是( )
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A、T1>T2,且a>0 |
| B、当温度为T2、反应进行到40 min时,x>0.15 |
| C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol |
| D、温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆) |
下列属于放热反应的是( )
| A、浓硫酸的稀释 |
| B、铝热反应 |
| C、氢气还原氧化铜 |
| D、Ba(OH)2?2H2O和NH4Cl(固体)混合 |
 请回答下列问题
请回答下列问题