题目内容
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO?2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的△H 0(填写“>”、“<”、“=”.)
(2)前2s内的平均反应速率v(N2)= .
(3)计算4s时NO的转化率 .
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是 .
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
①请在上表格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的△H
(2)前2s内的平均反应速率v(N2)=
(3)计算4s时NO的转化率
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号.

考点:化学平衡的计算,化学反应速率的影响因素,探究温度、压强对化学反应速率的影响
专题:
分析:(1)依据反应物的总能量与生成物的总能量大小判断;
(2)依据化学反应速率的概念结合图表数据分析计算一氧化氮的反应速率,结合速率之比等于系数之比;
(3)依据NO的转化率=
进行计算;
(4)依据影响反应速率的因素来分析;
(5)①根据实验目的验证温度、催化剂比表面积对化学反应速率的影响规律,则应保证浓度相同,然后相同温度时比较催化剂比表面积,相同催化剂比、表面积时比较温度;
②利用影响化学反应速率及化学平衡的因素来分析图象,利用影响化学反应速率及化学平衡的因素来分析、完成实验条件下混合气体中NO浓度随时间变化的趋势曲线图.
(2)依据化学反应速率的概念结合图表数据分析计算一氧化氮的反应速率,结合速率之比等于系数之比;
(3)依据NO的转化率=
| 转化量 |
| 总量 |
(4)依据影响反应速率的因素来分析;
(5)①根据实验目的验证温度、催化剂比表面积对化学反应速率的影响规律,则应保证浓度相同,然后相同温度时比较催化剂比表面积,相同催化剂比、表面积时比较温度;
②利用影响化学反应速率及化学平衡的因素来分析图象,利用影响化学反应速率及化学平衡的因素来分析、完成实验条件下混合气体中NO浓度随时间变化的趋势曲线图.
解答:
解:(1)2NO+2CO?2CO2+N2 若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则反应物的总能量大于生成物的总能量,所以反应是放热反应,△H<0,故答案为:<;
(2)前2s内的平均反应速度v(NO)=
=3.75×10-4mol/L?s:v(N2):v(NO)=1:2得到v(N2)=1.875×10-4mol/L?s,
故答案为:1.875×10-4mol/L?s;
(3)4s时NO的转化率=
=90%,故答案为:90%;
(4)A.选用更有效的催化剂,增大反应速率,故正确;
B.升高反应体系的温度,增大反应速率,故正确;
C.降低反应体系的温度,减小反应速率,故错误;
D.缩小容器的体积,相当于增大浓度,增大反应速率,故正确;
故选:ABD;
(5)①因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;
I、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,
故答案为:
②因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅰ、Ⅱ达平衡时NO的浓度相同,NO起始浓度为1.20×10-3;
表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为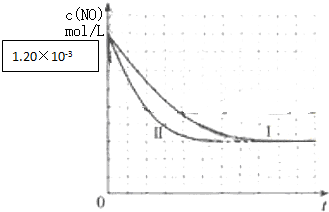 ,
,
故答案为: .
.
(2)前2s内的平均反应速度v(NO)=
| 1.00×10 -3-2.5×10 -4 |
| 2s |
故答案为:1.875×10-4mol/L?s;
(3)4s时NO的转化率=
| 1.0×10 -3-1.0×10 -4 |
| 1.0×10 -3 |
(4)A.选用更有效的催化剂,增大反应速率,故正确;
B.升高反应体系的温度,增大反应速率,故正确;
C.降低反应体系的温度,减小反应速率,故错误;
D.缩小容器的体积,相当于增大浓度,增大反应速率,故正确;
故选:ABD;
(5)①因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;
I、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,
故答案为:
| 实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的 比表面积(m2/g) |
| Ⅰ | ||||
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | |
| Ⅲ | 1.20×10-3 | 5.80×10-3 |
表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为
 ,
,故答案为:
 .
.
点评:本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,本题难度中等.

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应.在一定条件下与H2完全加成,加成产物一氯代物的同分异构体数目与该有机物一氯代物的同分异构体数目相比( )
| A、前者多 | B、后者多 |
| C、一样多 | D、无法确定 |
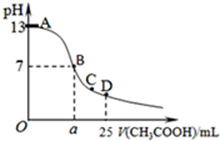 某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是( )
| A、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
相同条件下,等体积、等pH的醋酸溶液和盐酸溶液加水稀释相同的倍数后,所得溶液的pH( )
| A、仍相同 | B、醋酸溶液的大 |
| C、盐酸的大 | D、无法判断 |
下列气体是黄绿色的是( )
| A、Cl2 |
| B、N2 |
| C、SO2 |
| D、NO2 |
在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如下表:下列说法正确的是( )
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如下表:下列说法正确的是( )
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A、T1>T2,且a>0 |
| B、当温度为T2、反应进行到40 min时,x>0.15 |
| C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol |
| D、温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆) |
 请回答下列问题
请回答下列问题 四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表.试根据信息回答有关问题. 矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.
矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.