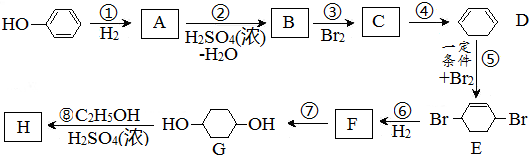
题目内容
 化合物C和E都是医用功能高分子材料,且组成中元素质量分数相同,均可由化合物A(C4H8O3)制得,如图所示.B和D互为同分异构体.
化合物C和E都是医用功能高分子材料,且组成中元素质量分数相同,均可由化合物A(C4H8O3)制得,如图所示.B和D互为同分异构体.试写出:(1)化学方程式A→D
(2)反应类型:A→B
(3)E的结构简式
(4)A的同分异构体(同类别有支链)的结构简式:
 .
.考点:有机物的推断
专题:有机物的化学性质及推断
分析:A的分子式为C4H8O3,具有酸性,含有-COOH,A在浓硫酸的作用下生成B,B可以使溴水褪色,由A、B分子式可知,A分子内脱去1分子水发生消去反应生成B,则A中还含有-OH,D是分子式为C4H6O2的五元环化合物,应是A发生酯化反应形成的环酯,则A的结构简式为HOCH2CH2CH2COOH,所以D为 ,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为
,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为 ,比较A、E的分子式可知,A发生缩聚反应得到E为
,比较A、E的分子式可知,A发生缩聚反应得到E为 ,据此解答.
,据此解答.
 ,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为
,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为 ,比较A、E的分子式可知,A发生缩聚反应得到E为
,比较A、E的分子式可知,A发生缩聚反应得到E为 ,据此解答.
,据此解答.解答:
解:A的分子式为C4H8O3,具有酸性,含有-COOH,A在浓硫酸的作用下生成B,B可以使溴水褪色,由A、B分子式可知,A分子内脱去1分子水发生消去反应生成B,则A中还含有-OH,D是分子式为C4H6O2的五元环化合物,应是A发生酯化反应形成的环酯,则A的结构简式为HOCH2CH2CH2COOH,所以D为 ,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为
,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为 ,比较A、E的分子式可知,A发生缩聚反应得到E为
,比较A、E的分子式可知,A发生缩聚反应得到E为 ,
,
(1)A→D的反应方程式为: ,
,
B→C的反应方程式为: ,
,
故答案为: ;
; ;
;
(2)A→B属于消去反应,B→C属于加聚反应,A→E属于缩聚反应,故答案为:消去反应;加聚反应;缩聚反应;
(3)由上述分析可知,E的结构简式为 ,故答案为:
,故答案为: ;
;
(4)A为HOCH2CH2CH2COOH,其同分异构体(同类别且有支链)的结构简式为: 、
、 ,
,
故答案为: ;
; .
.
 ,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为
,B为CH2=CHCH2COOH,B发生加聚反应得到高分子C为 ,比较A、E的分子式可知,A发生缩聚反应得到E为
,比较A、E的分子式可知,A发生缩聚反应得到E为 ,
,(1)A→D的反应方程式为:
 ,
,B→C的反应方程式为:
 ,
,故答案为:
 ;
; ;
;(2)A→B属于消去反应,B→C属于加聚反应,A→E属于缩聚反应,故答案为:消去反应;加聚反应;缩聚反应;
(3)由上述分析可知,E的结构简式为
 ,故答案为:
,故答案为: ;
;(4)A为HOCH2CH2CH2COOH,其同分异构体(同类别且有支链)的结构简式为:
 、
、 ,
,故答案为:
 ;
; .
.
点评:本题考查有机物推断,是对有机化合物知识的综合考查,关键是根据分子式、A与B的性质判断A发生的反应及含有官能团确定其结构,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
相关题目
某有机物燃烧后产物只有CO2和H2O,可推出的结论是这种有机物中( )
| A、一定只有C、H、O |
| B、可能含有C、H、O |
| C、一定含有C、H、无O |
| D、一定含有C、H、可能有O |
下列叙述正确的是( )
| A、两种难溶物质比较,溶度积小的溶解度不一定小 | ||||
| B、水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 | ||||
C、向0.1mol/L的氨水中加入少量硫硫酸固体,则溶液中
| ||||
| D、0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列叙述正确的是( )
| A、白铁(镀锌)的表面一量破损,铁腐蚀加快 |
| B、原电池中电子向负极流动 |
| C、马口铁(镀锡)的表面一旦破损,铁腐蚀加快 |
| D、用铝质铆钉接铁板,铁易被腐蚀 |
 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.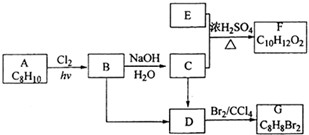
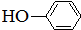 合成
合成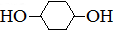 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)