题目内容
 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.(1)反应2SO2(g)+O2(g)?2SO3(g)是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
A.加入V2O5作催化剂,.B.通过量空气C.高温D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=
(3)能说明该反应已经达到平衡状态的是
A.v(SO2)=2v(O2)
B.容器内压强保持不变.
B.v逆(SO3)=v正(SO2)
D.容器内物质的密度保持不变.
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染,请写出CH4与NO反应的化学方程式:
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)有利于提高SO2平衡转化率,说明平衡向着正向移动,根据各选项条件对化学平衡的影响进行判断;
(2)依据化学平衡的三段式列式计算平衡浓度,结合平衡常数概念计算;依据化学平衡的影响因素和移动原理分析判断;
(3)根据平衡状态的特征判断各个选项;
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,由此作图.
(2)依据化学平衡的三段式列式计算平衡浓度,结合平衡常数概念计算;依据化学平衡的影响因素和移动原理分析判断;
(3)根据平衡状态的特征判断各个选项;
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,由此作图.
解答:
解:(1)A、加入催化剂,催化剂不影响化学平衡,二氧化硫的转化率不变,故错误;
B、通入过量的空气,平衡向着正向移动,二氧化硫的转化率增大,故正确;
C、升高温度,平衡向着逆向移动,二氧化硫的转化率减小,故错误;
D、增大压强,增大压强,平衡向着正向移动,二氧化硫的转化率增大,故正确;
故选:BD;
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=
=5.76;
用O2的浓度变化表示从O-2min内该反应的平均速率v=
=0.125mol/(L?min)
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%,
故答案为:5.76;0.125mol/(L?min);<;
(3)A.v(SO2)=2v(O2),只要反应发生,速率之比就符合这样的关系,故错误;
B.容器内压强保持不变,说明达平衡状态,故正确.
C.v逆(SO3)=v正(SO2),正逆反应速率相等,故正确;
D.容器内物质的密度始终保持不变,故错误;
故选:BC;
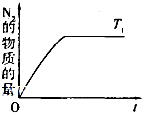
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,所以图形为: ,故答案为:CH4+4NO═2N2+CO2+2H2O;
,故答案为:CH4+4NO═2N2+CO2+2H2O; ;
;
B、通入过量的空气,平衡向着正向移动,二氧化硫的转化率增大,故正确;
C、升高温度,平衡向着逆向移动,二氧化硫的转化率减小,故错误;
D、增大压强,增大压强,平衡向着正向移动,二氧化硫的转化率增大,故正确;
故选:BD;
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=
| 0.62 |
| 0.52×0.25 |
用O2的浓度变化表示从O-2min内该反应的平均速率v=
| 0.25 |
| 2 |
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%,
故答案为:5.76;0.125mol/(L?min);<;
(3)A.v(SO2)=2v(O2),只要反应发生,速率之比就符合这样的关系,故错误;
B.容器内压强保持不变,说明达平衡状态,故正确.
C.v逆(SO3)=v正(SO2),正逆反应速率相等,故正确;
D.容器内物质的密度始终保持不变,故错误;
故选:BC;
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,所以图形为:
 ,故答案为:CH4+4NO═2N2+CO2+2H2O;
,故答案为:CH4+4NO═2N2+CO2+2H2O; ;
;
点评:本题考查了影响化学反应的速率、化学平衡的三段式计算应用,平衡常数的概念应用,图象分析判断,化学方程式的书写,题目难度较大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
据报道,最近某公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.则下列说法正确的是( )
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阴极 |
| C、放电时电解质溶液的pH逐渐增大 |
| D、充电时每生成1 mol CH3OH转移12 mol电子 |
下列溶液中Cl-的物质的量浓度与l00mL1moL/LMgCl2溶液中Cl-的物质的量浓度相同的是( )
| A、50mL2mol/LCaCl2溶液 |
| B、100mL2moL/LNaCl溶液 |
| C、50mL4mol/LCaCl2溶液 |
| D、100mL4mol/LNaCl溶液 |
下列离子方程式中,正确的是( )
| A、过氧化钠与水反应2O22-+2H2O=4OH-+O2↑ |
| B、铝与氢氧化钠溶液反应Al+OH-+H2O=AlO2-+H2↑ |
| C、硫酸铝和氨水反应Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、氯气与氢氧化钠溶液反应Cl2+2OH-=Cl-+ClO-+H2O |
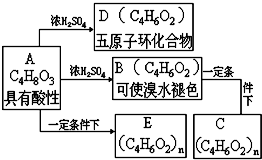 化合物C和E都是医用功能高分子材料,且组成中元素质量分数相同,均可由化合物A(C4H8O3)制得,如图所示.B和D互为同分异构体.
化合物C和E都是医用功能高分子材料,且组成中元素质量分数相同,均可由化合物A(C4H8O3)制得,如图所示.B和D互为同分异构体.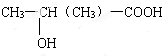 .
.