题目内容
8.4P(红磷s)=P4(白磷s);△H=+17kJ•mol-1根据以上方程式,下列推论正确的是( )
| A. | 当lmol白磷转变成红磷时放出17kJ热量 | |
| B. | 当4g红磷转变成白磷时吸收17kJ热量 | |
| C. | 正反应是一个放热反应 | |
| D. | 白磷热稳定性比红磷大 |
分析 A.热化学方程式的正反应是吸热反应则逆反应是放热反应;
B.热化学方程式的系数只能表示物质的量;
C.根据焓变符号来确定反应的吸放热情况;
D.物质具有的能量越低越稳定.
解答 解:A.该热化学方程式的正反应是吸热反应则逆反应是放热反应,即当lmol白磷转变成红磷时放出17kJ热量,故A正确;
B.热化学方程式的系数只能表示物质的量,当4mol红磷转变成白磷时吸收17kJ热量,故B错误;
C.4P(红磷s)→P4(白磷s);△H=+17kJ•mol-1,焓变大于零,确定反应为吸热反应,故C错误;
D.根据4P(红磷s)→P4(白磷s);△H=+17kJ•mol-1,则反应物的能量低于生成物的,所以红磷具有的能量低,即白磷稳定性比红磷答,故D正确;
故选AD.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确物质具有能量与稳定性的关系为解答关键,注意掌握热化学方程式的表示方法及意义,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
18.某学生将1-氯乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
19.能清楚地反映甲烷分子里碳、氢原子的大小和相对空间位置的是( )
| A. | 结构式 | B. | 电子式 | C. | 球棍模型 | D. | 分子式 |
16.如图为铜锌原电池示意图,下列说法中不正确的是( )
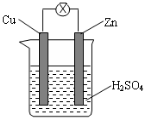

| A. | 锌片逐渐溶解,铜片上有气泡 | B. | 锌片为正极,铜片为负极 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 该装置能够将化学能转化为电能 |
3.现有部分短周期主族元素的性质或原子结构如表:
(1)元素Y在周期表中的位置第二周期第ⅤA族(周期、族).
(2)XN2的电子式是: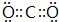 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式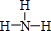 .
.
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)用电子式表示WZ的形成过程 .
.
(5)元素Z和T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是B.
A.常温下Z单质和T单质状态不同B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式2Na+2H2O=2NaOH+H2↑所得溶液的溶质是离子化合物(填“离子”或“共价”).
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
(2)XN2的电子式是:
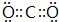 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式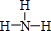 .
.(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)用电子式表示WZ的形成过程
 .
.(5)元素Z和T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是B.
A.常温下Z单质和T单质状态不同B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式2Na+2H2O=2NaOH+H2↑所得溶液的溶质是离子化合物(填“离子”或“共价”).