题目内容
18.某学生将1-氯乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
分析 1-氯乙烷中的氯元素不是以离子状态存在的,因此不能与AgNO3溶液直接反应,必须使之变为Cl-,反应后溶液显碱性,不能直接加AgNO3溶液,否则Ag+与OH-反应得到Ag2O黑色沉淀,影响氯的检验.
解答 解:1-氯乙烷中的氯元素不是以离子状态存在的,因此不能与AgNO3溶液直接反应,必须使之变为Cl-.因此,应通过1-氯乙烷在碱性溶液中水解得到,但要注意,反应后溶液显碱性,不能直接加AgNO3溶液,否则Ag+与OH-反应得到Ag2O黑色沉淀,影响氯的检验,所以应加入足量硝酸酸化后,再加AgNO3溶液检验.
故选C.
点评 本题考查氯离子的检验,题目难度中等,注意碱性条件下生成的AgOH不稳定,易分解生成Ag2O黑色沉淀而影响实验现象.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.4P(红磷s)=P4(白磷s);△H=+17kJ•mol-1
根据以上方程式,下列推论正确的是( )
根据以上方程式,下列推论正确的是( )
| A. | 当lmol白磷转变成红磷时放出17kJ热量 | |
| B. | 当4g红磷转变成白磷时吸收17kJ热量 | |
| C. | 正反应是一个放热反应 | |
| D. | 白磷热稳定性比红磷大 |
 ,据此填写下列空格.
,据此填写下列空格.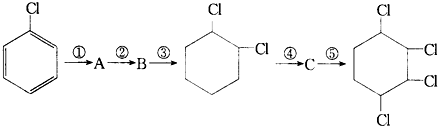
 B
B
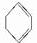 .
.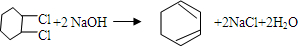 .
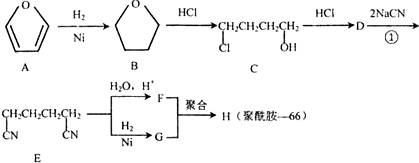
.
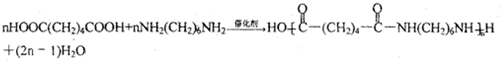 .
.