题目内容
19.能清楚地反映甲烷分子里碳、氢原子的大小和相对空间位置的是( )| A. | 结构式 | B. | 电子式 | C. | 球棍模型 | D. | 分子式 |
分析 根据球棍模型是用球表示原子,用小棍表示化学键,用于表现结构;比例模型是按分子中各原子所占体积比例制作的,也可以真实表示其结构,分子式、电子式、结构式不能表示出C原子和H原子的相对大小.
解答 解:甲烷的比例模型更能够反映其真实存在状况,球棍模型是利用短线代替其共价键,也可以真实表示原子所在位置和原子的相对大小,分子式、结构式、电子式不能表示出C原子和H原子的相对大小,不能反映其空间构型,
故选C.
点评 本题考查学生对甲烷分子结构的熟悉了解程度,题目难度不大,试题侧重基础知识的考查,意在培养学生的空间想象能力,有利于提高学生的学习兴趣和学习积极性.

练习册系列答案
相关题目
14.现有部分短周期元素的性质、应用或原子结构如下表:
(1)元素X可测定文物年代的同位素符号是614C.
(2)元素Z在周期表中的位置为第三周期ⅦA族.Y单质的结构式为N≡N.
(3)元素Y与氢元素形成一种离子YH4+,实验室检验溶液中含有这种离子方法是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层电子数的3倍 |
| X | 一种同位素可测定文物年代 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Z在周期表中的位置为第三周期ⅦA族.Y单质的结构式为N≡N.
(3)元素Y与氢元素形成一种离子YH4+,实验室检验溶液中含有这种离子方法是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
4.在海水浓缩过程中,析出盐的种类和质量见下表,(单位g/L)
当海水密度达到1.21~1.22g/mL时,析出的盐中,质量分数最大的是( )
| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | Mg SO4 | NaBr |
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
| A. | CaSO4 | B. | MgSO4 | C. | NaCl | D. | MgCl2 |
11.下列说法中,正确的是( )
| A. | 浓硫酸稀释时溶液温度升高,说明浓硫酸稀释只有水合过程 | |
| B. | 蔗糖是非电解质,放入水中溶液温度没有明显变化,说明蔗糖溶于水既没有扩散过程也没有水合过程 | |
| C. | 家用石碱(Na2CO3•10H2O)久置后,由块状变成粉末状,这一变化是风化的结果 | |
| D. | 从冰箱中取出物品,表面很快出现水珠,这种现象叫潮解 |
8.4P(红磷s)=P4(白磷s);△H=+17kJ•mol-1
根据以上方程式,下列推论正确的是( )
根据以上方程式,下列推论正确的是( )
| A. | 当lmol白磷转变成红磷时放出17kJ热量 | |
| B. | 当4g红磷转变成白磷时吸收17kJ热量 | |
| C. | 正反应是一个放热反应 | |
| D. | 白磷热稳定性比红磷大 |
9.下列实验装置或实验操作能达到相应实验目的是( )
| A | B | C | D |
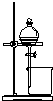 | 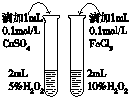 | 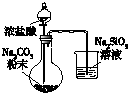 | 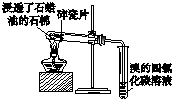 |
| 用于分离苯萃取碘水后的有机层和水层 | 比较不同种催化剂对反应速率的影响 | 验证酸性:H2CO3>H2SiO3 | 证明石蜡油分解生成的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
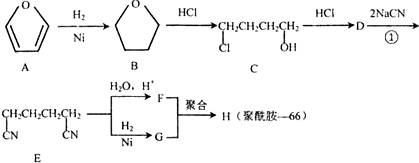
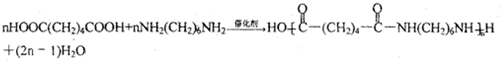 .
.