题目内容
13.某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是过滤,试剂a是K2CO3 (填化学式).
(2)加入试剂b所发生反应的化学方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O.
(3)用分离出的固体B配制100mL 0.5mol/L的溶液B,现有可供选择的仪器:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.量筒;F.托盘天平.回答下列问题:
①用托盘天平称得固体B的质量是10.4 g.
②配制溶液B时,上述仪器中一定不需要使用的有B(填字母),还缺少的仪器有100mL容量瓶、玻璃棒 (写仪器名称).
③如下情况使所配溶液B的物质的量浓度偏高的是a.
a.某同学在定容观察液面时俯视
b.容量瓶清洗后没有干燥
c.在移液时不慎有少量液体流到容量瓶外.
分析 分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,蒸发结晶得到固体C为KCl和K2CO3,应加入过量盐酸可得KCl,沉淀A为BaCO3,洗涤后,加盐酸,蒸发得到固体B为BaCl2,
根据n=cV计算溶质的物质的量,根据m=nM计算质量,结合配制步骤确定实验使用仪器以及不当操作可能导致的误差,以此来解答.
解答 解:分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,蒸发结晶得到固体C为KCl和K2CO3,应加入过量盐酸可得KCl,沉淀A为BaCO3,洗涤后,加盐酸,蒸发得到固体B为BaCl2,
(1)操作②为固体和液体的分离,为过滤操作,试剂a是K2CO3溶液,用于除去氯化钡,
故答案为:过滤;K2CO3;
(2)BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的化学方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O,故答案为:BaCO3+2HCl=BaCl2+CO2↑+H2O;
(3)①固体B的质量是0.1L×0.5mol/L×208g/mol=10.4g,故答案为:10.4;
②固体配制溶液,称量后溶解、定容等,不需要烧瓶,还缺少的仪器有100mL容量瓶、玻璃棒,故答案为:B;100mL容量瓶、玻璃棒;
③a.某同学在定容观察液面时俯视,则V偏小,由c=$\frac{n}{V}$可知,c偏大,故选;
b.容量瓶清洗后没有干燥,n、V均不变,c无影响,故b不选;
c.在移液时不慎有少量液体流到容量瓶外,n偏小,由c=$\frac{n}{V}$可知,c偏小,故c不选;
故答案为:a.
点评 本题考查物质的分离、提纯操作,为高频考点,侧重于考查学生分析能力、实验能力,注意把握流程中的反应及混合物分离方法的选择,把握溶液的配制,难度不大.

| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | Mg SO4 | NaBr |
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
| A. | CaSO4 | B. | MgSO4 | C. | NaCl | D. | MgCl2 |
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图(图1)和有关数据如下:
| 相对原子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
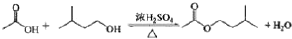
实验步骤:
在A中加入4.4g的异戊醇、6.0g的乙酸、数滴浓硫酸和2~3 片碎瓷片.开始缓慢加热A.回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静里片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B 的名称是球形冷凝管.
(2)在洗涤操作中.第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡.然后静置,待分层后D(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出.再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口例出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥乙酸异戊酯.
(6)在蒸馏操作中,仪器选择及安装都正确的是图2中b(填标号).
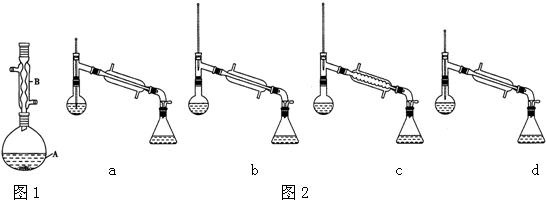
(7)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”)
根据以上方程式,下列推论正确的是( )
| A. | 当lmol白磷转变成红磷时放出17kJ热量 | |
| B. | 当4g红磷转变成白磷时吸收17kJ热量 | |
| C. | 正反应是一个放热反应 | |
| D. | 白磷热稳定性比红磷大 |
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的小(填“大”或“小”);X和Y的气态氢化物中,较稳定的是H2O(写化学式);
(3)Z元素形成简单离子的离子结构示意图
 ;
;(4)XY2由固态变为气态所需克服的微粒间作用力是范德华力;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称是乙酸.
| A. | Na2O2既是氧化剂,又是还原剂 | |
| B. | O2是还原产物,Mn2+是氧化产物 | |
| C. | 通常用浓盐酸酸化高锰酸钾溶液 | |
| D. | 标准状况下,产生22.4 L O2时反应转移2 mol e- |
 B
B
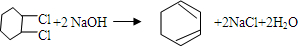
 .
. .
.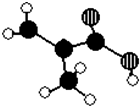 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).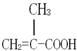 ,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.
,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.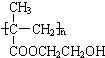 .
.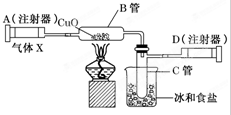 如图所示的实验装置可用来测定含两种元素的气体X的分子式.
如图所示的实验装置可用来测定含两种元素的气体X的分子式.